
来源:特诺科研
皮克病(PiD)作为罕见的额颞叶痴呆(FTD)亚型,与阿尔茨海默病(AD)同属 tau 蛋白病,但因样本稀缺、研究不足,其分子调控机制长期处于 “黑箱” 状态。近日,加州大学欧文分校(UCI)Zechuan Shi、Vivek Swarup 团队在《Science Advances》(IF=12.5,国际顶级综合期刊)发表重磅研究:通过单细胞核ATAC-seq(snATAC-seq)和 RNA-seq(snRNA-seq)多组学技术,首次系统解析PiD 与AD 前额叶皮层的表观遗传与转录调控差异,发现人类特异性增强子(HGE)调控 UBE3A 的关键机制,揭示神经元与胶质细胞中共享 / 独特的转录因子(TF)调控网络,为 tau 病的精准干预提供全新靶点与研究工具!

文章信息速览
原标题:Single-nucleus multi-omics identifies shared and distinct pathways in Pick’s and Alzheimer’s disease
期刊:Science Advances(国际顶级综合期刊,IF=12.5,JCR Q1,聚焦跨学科创新研究)
关键词:皮克病(PiD)、阿尔茨海默病(AD)、tau 蛋白病、单细胞核多组学、UBE3A、人类特异性增强子(HGE)、转录因子调控网络、scROAD 数据库
核心创新:① 首次对 PiD 进行单细胞核多组学分析,对比 AD 揭示 tau 病的共享 / 独特调控机制;② 发现 UBE3A 的人类特异性增强子(HGE),CRISPR 验证其调控神经元功能;③ 解析神经元 / 胶质细胞中差异 TF 结合模式,构建疾病特异性调控网络;④ 开发交互式数据库 scROAD,开放共享单细胞核 TF 结合与调控网络数据。
研究背景与临床痛点
两种 tau 蛋白病的核心困境亟待突破:
PiD 研究缺口大:作为罕见 FTD 亚型,PiD 样本稀缺、临床诊断困难,其表观遗传与转录调控机制几乎空白;
tau 病机制差异不明:AD 与 PiD 均以异常 tau 聚集为特征,但临床表型(PiD 以额颞叶受累为主,AD 以海马受累为主)和进展速度差异显著,共享 / 独特分子机制未知;
非编码区变异功能不清:GWAS 发现的 neurodegeneration 风险变异多位于非编码区,但其在 PiD/AD 中的细胞类型特异性功能难以解析;
缺乏针对性靶点:两种疾病均无根治手段,亟需基于机制的精准治疗靶点。
研究核心目标:① 解析 PiD 与 AD 前额叶皮层的单细胞核表观遗传与转录组动态;② 鉴定两者共享 / 独特的调控通路与关键基因;③ 验证非编码调控元件的功能,为治疗提供靶点。
研究核心亮点
这篇顶刊研究以“多组学对比 + 功能验证” 为核心,4 大突破填补 tau 病研究空白:
1. 技术突破:单细胞核多组学首次描绘 PiD 分子图谱,跨疾病对比无死角
采用高分辨率单细胞核技术,实现两种 tau 病的全维度解析:
样本覆盖:7 例 PiD 患者、12 例晚期 AD 患者、17 例认知正常对照,采集前额叶皮层(PFC)组织,完成 snATAC-seq(捕获 19.8 万 + 细胞核)和 snRNA-seq(捕获 12.4 万 + 细胞核)(图1A);
技术组合:snATAC-seq(解析染色质可及性)+ snRNA-seq(解析基因表达)+ CRISPR-Cas9(验证增强子功能)+ 精细定位(fine-mapping)GWAS 风险位点,多维度交叉验证;
细胞分型:鉴定出 7 大核心细胞类型(兴奋性神经元、抑制性神经元、星形胶质细胞、小胶质细胞、少突胶质细胞、OPC、周细胞 / 内皮细胞),明确各细胞类型在两种疾病中的调控差异(图1B-E)。
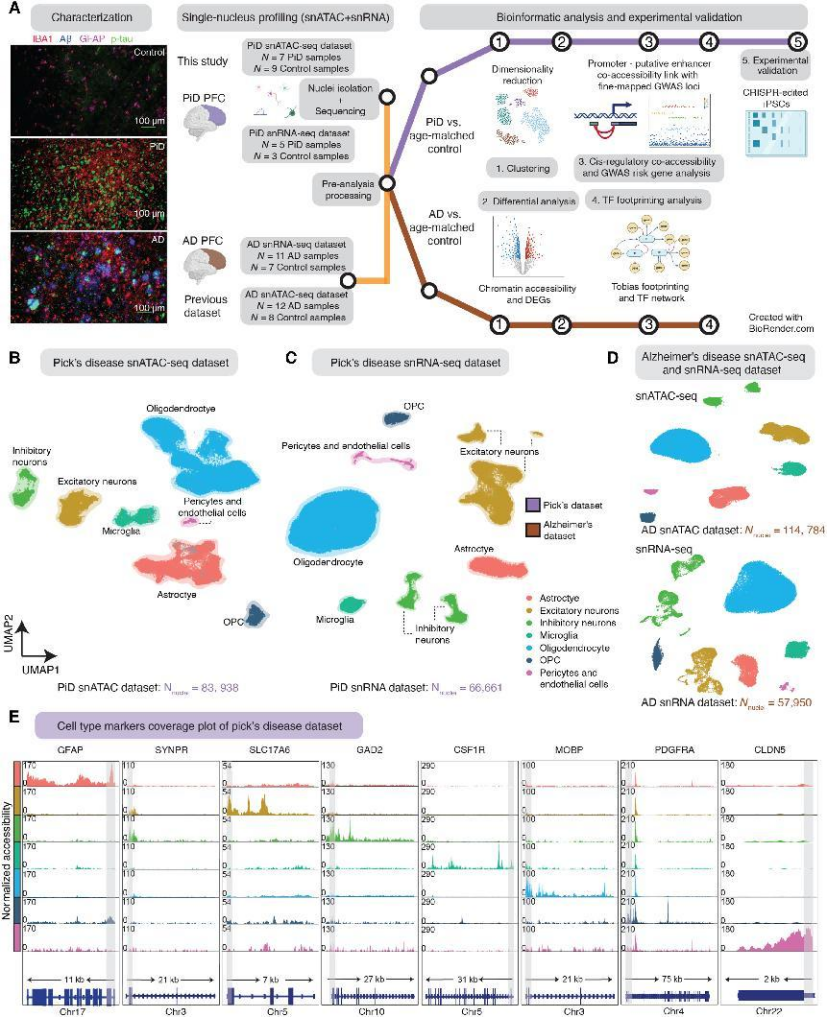
图1
2. 核心机制:UBE3A 的人类特异性增强子(HGE),两种 tau 病的共同调控靶点
首次发现并验证 PiD 与 AD 中关键基因 UBE3A 的非编码调控机制:
关键发现:PiD 患者兴奋性神经元中,UBE3A 的一个远端人类特异性增强子(HGE)染色质可及性显著升高,但 UBE3A 转录水平却下调(图2A、H),提示 “染色质开放代偿性调控”;
功能验证:CRISPR-Cas9 敲除该 HGE 后,iPSC 衍生神经元中 UBE3A 表达显著降低,且下游泛素化、凋亡、突触功能相关通路紊乱(图2C-E),证实该 HGE 是 UBE3A 的关键调控元件;
疾病关联:UBE3A 功能异常与突触功能障碍密切相关,其下调可能参与 PiD/AD 的突触丢失病理过程(图2G、J)。
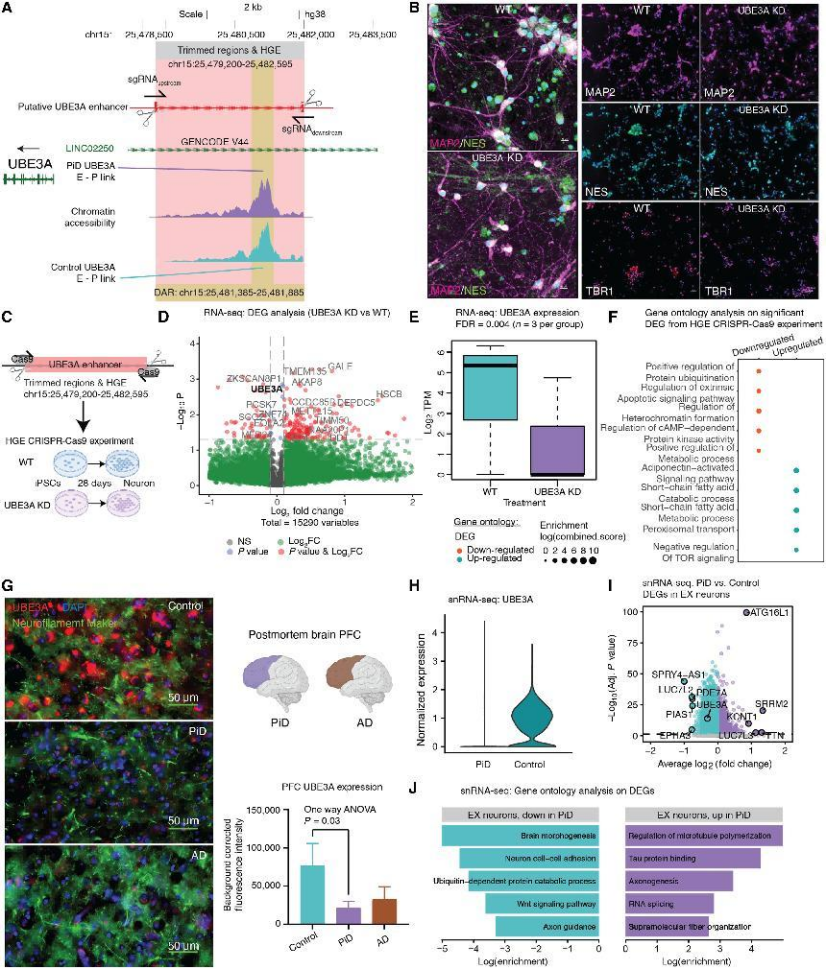
图2
3. TF 调控网络:神经元与胶质细胞的 “共享 / 独特” 调控密码
解析两种疾病中神经元与胶质细胞的转录因子(TF)结合差异,揭示 tau 病调控共性与特异性:
兴奋性神经元:PiD 中 TF 下调更显著(如 CTCF、BHLHE22),AD 中特有 JDP2(凋亡相关 TF)上调;共享 TF 如 RORA(能量代谢相关)在两者中均上调(图3B、G);
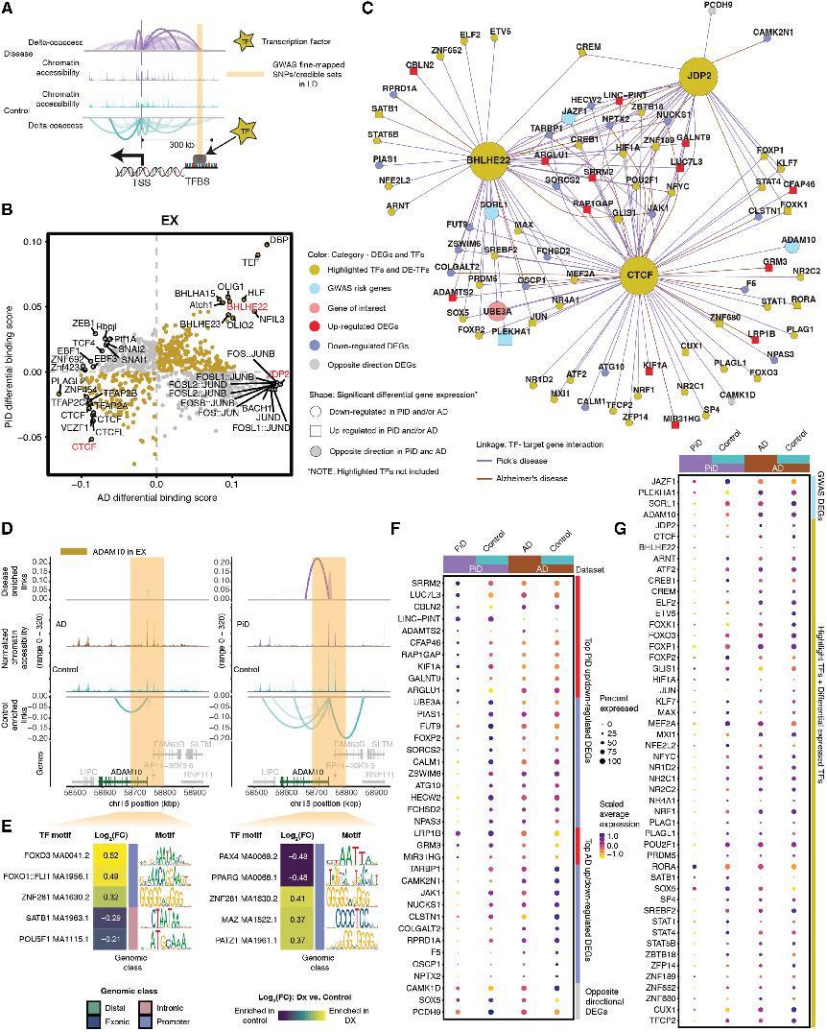
图3
胶质细胞:① 小胶质细胞:PiD 与 AD 均出现 SPI1(AD GWAS 风险基因)结合增强,AD 特有 MAF、CX3CR1 下调;② 星形胶质细胞:AP-1 家族 TF(JUND、JUNB)在两者中均富集,PiD 特有 HIF1A 下调;③ 少突胶质细胞:转录抑制因子 HES1、ZBTB33 在两者中均激活,调控 MAPT(tau 编码基因)表达(图4A-F);
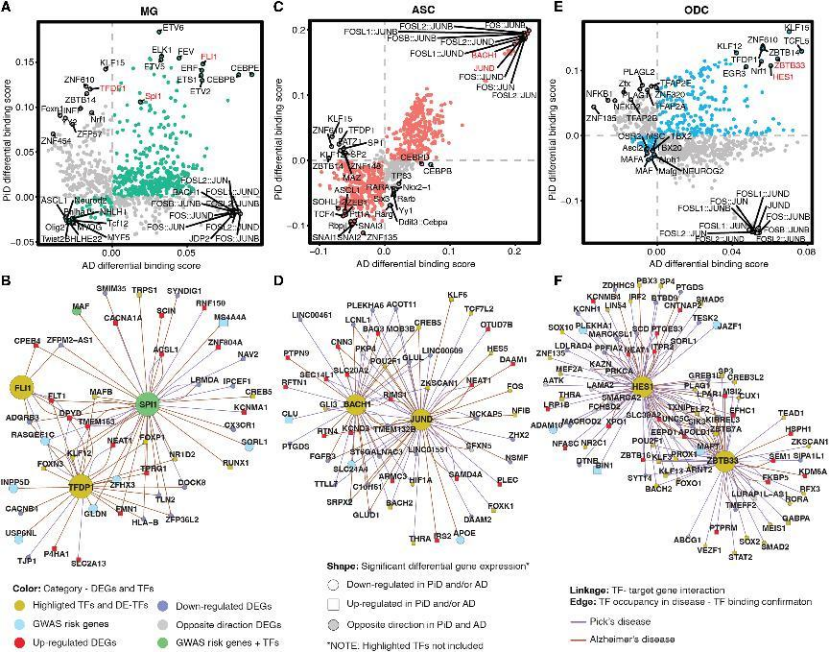
图4
核心价值:明确不同细胞类型的 TF 调控差异,为 “细胞类型特异性靶向治疗” 提供依据。
4. 临床转化:scROAD 交互式数据库,开放赋能全球研究
构建首个针对 PiD 与 AD 的单细胞核调控网络数据库,降低研究门槛:
数据库功能:可视化单细胞核 TF 结合位点、增强子 - 启动子互作、GWAS 风险位点注释,支持检索关键基因(如 UBE3A、ADAM10)的调控通路(http://swaruplab.bio.uci.edu/scROAD);
额外价值:整合 AD/FTD GWAS 精细定位数据,发现 36 个风险位点与特定细胞类型的染色质可及性重叠(如 INPP5D 仅在小胶质细胞中富集),为非编码变异功能解析提供工具(图3)。
临床价值
首先对患者而言,这份研究为罕见病 PiD 提供首个单细胞核水平的分子机制图谱,为开发针对性治疗(如靶向 UBE3A 增强子调控)奠定基础;
在临床上,明确 AD 与 PiD 的共享(如 UBE3A 调控异常)与独特(如神经元 TF 下调模式)病理机制,避免 “tau 病一刀切” 的治疗思路,助力精准分层;
对科研:① 提供 PiD 的多组学数据集,填补罕见病研究空白;② scROAD 数据库开放共享,加速 tau 病调控网络研究;③ 建立 “多组学 + CRISPR 验证” 的非编码区功能解析范式,为其他神经退行性疾病提供参考。
总体而言,这篇研究的核心突破在于,首次通过单细胞核多组学技术破解了罕见病 PiD 的分子黑箱,同时揭示了 PiD 与 AD 这两种 tau 病的 “共性与个性”—— 共享 UBE3A 调控异常等核心通路,却在神经元 / 胶质细胞的 TF 结合模式上存在显著差异。CRISPR 验证的 UBE3A 人类特异性增强子,以及开放共享的 scROAD 数据库,不仅为 tau 病的机制研究提供了关键工具,更为开发 “细胞类型特异性 + 疾病特异性” 的精准治疗方案开辟了新路径。
原文DOI:10.1126/sciadv.ads7973
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号