
来源:特诺科研
食管癌是全球高发的“致命癌种”—— 发病率排第 7、死亡率排第 6,5 年生存率不足20%,肿瘤异质性高导致治疗响应参差不齐!近日,成都医学院、南部县人民医院刘华、杨静团队在《International Journal of Surgery》(IF=10.3,外科顶刊)发表重磅成果:首次整合微生物组、转录组、甲基化等多组学数据,将食管癌分为C1、C2 两个微生物组相关亚型,明确C1 亚型对化疗/ EGFR 抑制剂敏感,C2 亚型为“免疫热肿瘤”,STAT3 抑制剂 + PD-L1 抗体联合治疗可显著增效!
文章信息速览
原标题:Multi-Omics Analysis Reveals Microbiome-Associated Subtypes of Esophageal Cancer with Distinct Immune Profiles and Therapeutic Responses
期刊:International Journal of Surgery(IF=10.3)
关键词:食管癌、微生物组、多组学、分子亚型、免疫治疗、靶向治疗、STAT3抑制剂、EGFR抑制剂
研究背景与临床痛点
食管癌治疗的“三大难题” 亟待突破:
预后极差:5 年生存率不足 20%,晚期患者缺乏有效治疗方案,精准分层工具缺失;
异质性高:不同患者对化疗、免疫治疗响应差异大,“一刀切” 治疗效果不佳;
机制模糊:肿瘤微生物组在食管癌中的作用尚未明确,缺乏“微生物组 - 免疫 - 治疗响应” 的完整关联;
研究核心亮点:
第一步:微生物组先验,发现肿瘤与正常正常组织的菌群差异(图 1)
研究先从微生物组切入,对比食管癌组织与正常组织的菌群组成:
核心发现:肿瘤组织中变形菌门(93.5% vs 正常组织 87.1%)和假单胞菌属(83.4% vs 正常组织 75.3%)显著富集,而放线菌门(3.5% vs 正常组织 9.1%)减少(图 1A-L);
临床关联:假单胞菌属丰度与性别、年龄、肿瘤分期、组织学亚型相关(男性、高龄、晚期患者丰度更高);
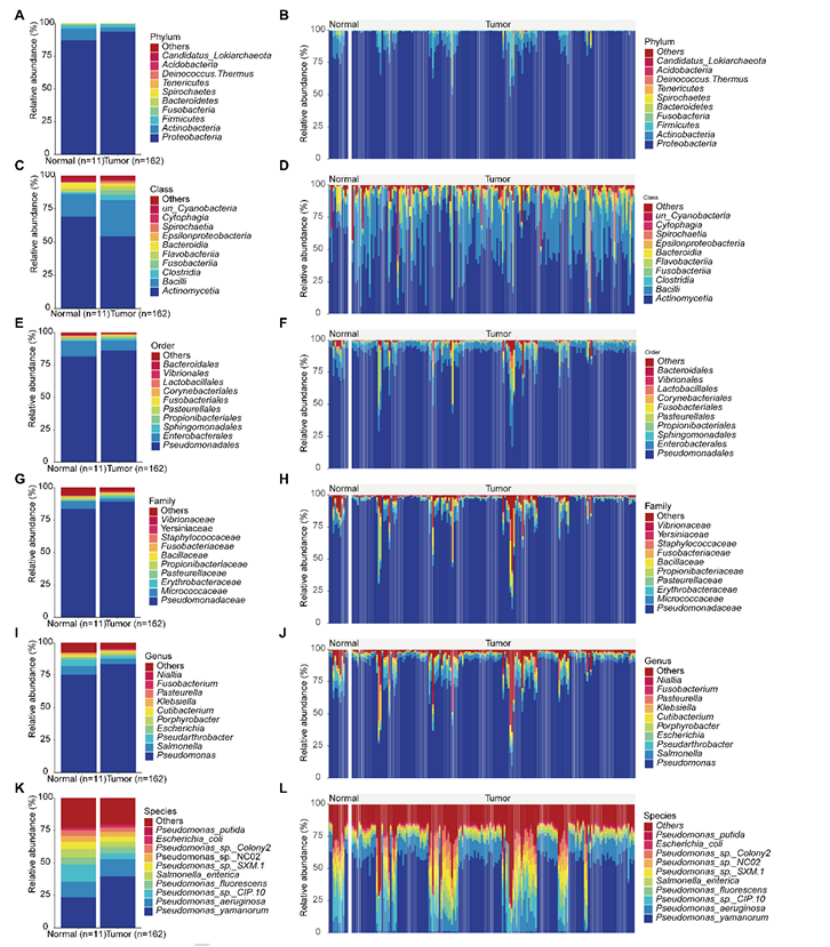
图1
医生发文启示:微生物组可作为“切入点”,先明确疾病与正常组织的差异特征,为后续多组学整合奠定基础,顶刊青睐这种 “表型 - 分子” 的递进逻辑。
第二步:多组学共识聚类,锁定 2 个稳定亚型(图 2)
整合 TCGA-ESCA 队列的转录组(mRNA/lncRNA/miRNA)、甲基化、突变组、微生物组数据,通过 10 种聚类算法共识分析:
亚型鉴定:最优聚类数为 2(C1、C2),轮廓分析验证聚类稳定性(图 2B),10 种算法结果一致(图 2C);
亚型特征:C1 亚型高表达特定 RNA 和 DNA 甲基化,C2 亚型高 TMB + 假单胞菌富集(图 2D);
预后差异:C1 亚型总生存期显著优于 C2 亚型(P=0.009,图 2E);
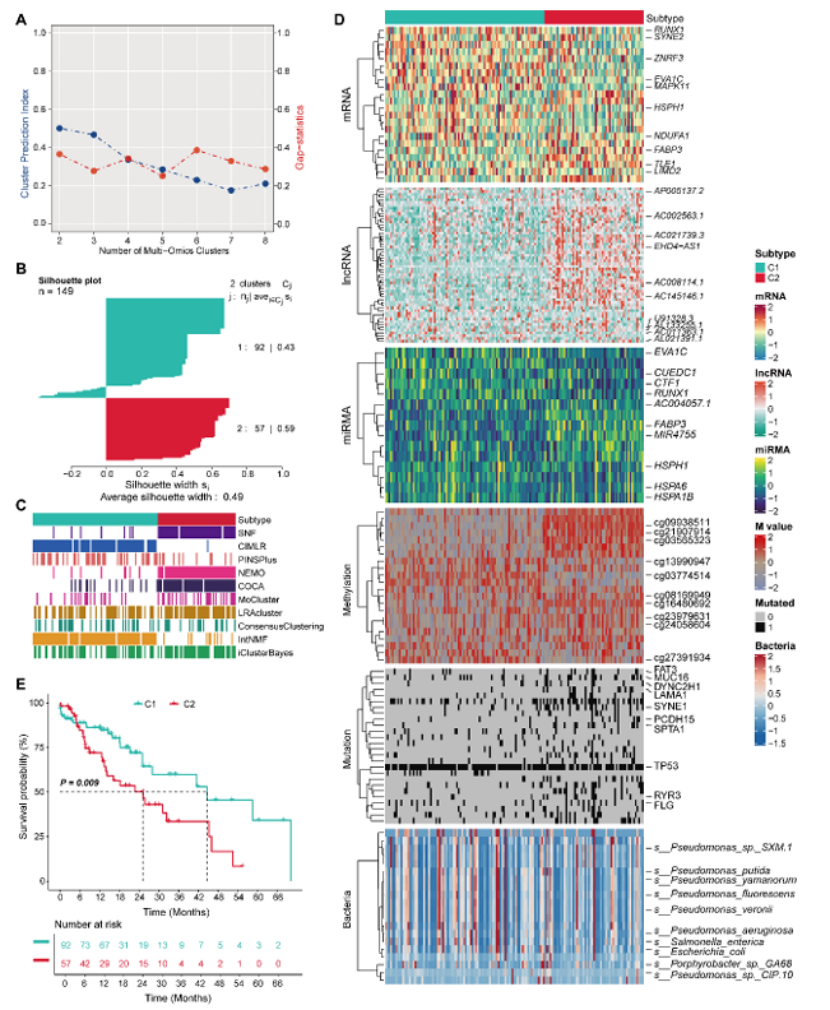
图2
医生发文启示:多算法共识聚类 + 多组学整合是提升分型稳定性的关键,顶刊重视分型的 “可重复性”,避免单一算法或单一组学的局限性。
第三步:亚型深度刻画,解析临床 + 免疫 + 微生物特征(图 3-4)
全面对比两个亚型的临床、免疫、微生物、突变特征:
临床特征:C2 亚型更具侵袭性 —— 高龄患者占比 60%(C1 仅 26%)、晚期(III/IV 期)占比 52%(C1 仅 32%)、淋巴结转移率 69%(C1 仅 44%),且 100% 为腺癌(C1 含 14% 腺癌)(图 3A-H);
免疫特征:C2 为 “免疫热肿瘤”—— 富集效应记忆 CD4+T 细胞、Treg、M2 巨噬细胞,免疫 / 基质评分更高;C1 为 “免疫冷肿瘤”—— 富集 Th1 细胞、树突状细胞(图 3I-J);

图3
微生物特征:C1 富集伯克霍尔德菌、哈氏弧菌等,C2 富集假单胞菌属(假单胞菌地中海亚种、维罗尼假单胞菌等);
突变特征:C2 亚型 TMB 更高(P=2.66e-09),TP53 突变率 77%(C1 为 88%),富集 TTN、MUC16 突变;C1 亚型特有 NFE2L2、NOTCH3 突变(图 4A-C);

图4
医生发文启示:亚型刻画需“多维度交叉验证”,结合临床预后、免疫微环境、微生物、突变特征,让分型更具临床意义和分子基础。
第四步:治疗响应预测,明确亚型特异性治疗方向(图 5)
通过 TIDE 算法和药物敏感性分析,锁定各亚型治疗靶点:
免疫治疗:C2 亚型 TIDE 评分低(P<0.0001)、T 细胞排除评分低,免疫治疗预测响应率 67%(C1 仅 27%)(图 5A-E);
化疗 / 靶向治疗:C1 亚型对顺铂、吉西他滨、依托泊苷等化疗药,以及阿法替尼、吉非替尼等 EGFR 抑制剂更敏感(IC50 更低,图 5F-G);
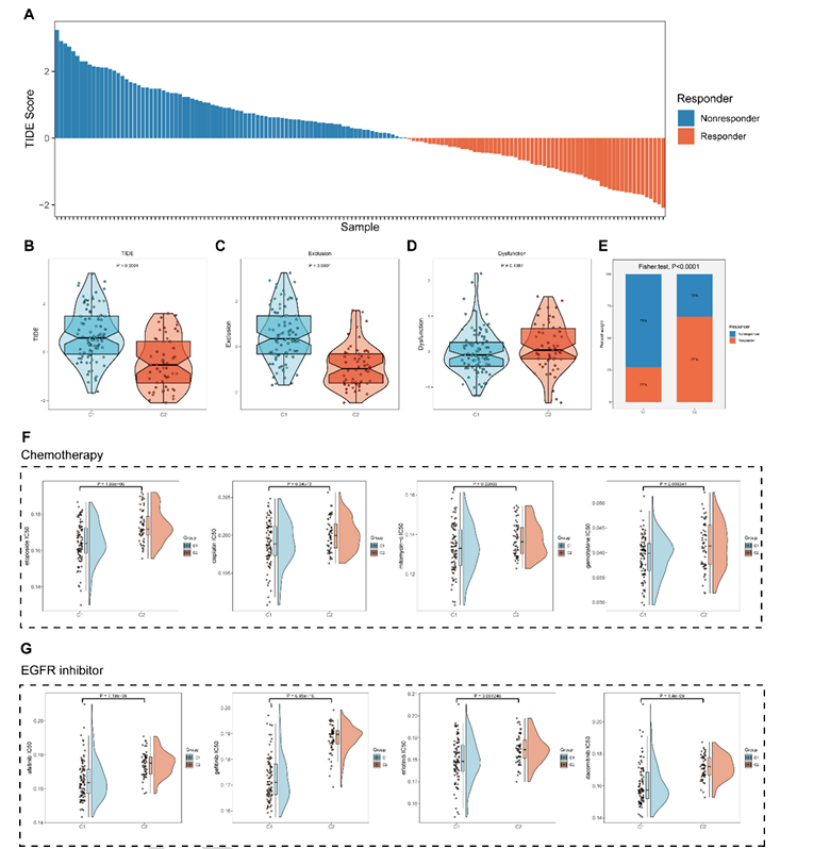
图5
医生发文启示:分型的核心价值是“指导治疗”,顶刊必看 “分型与治疗响应” 的关联,需通过数据库预测 + 后续实验验证,形成 “分型 - 治疗” 的逻辑链。
第五步:机制 + 体内外验证,敲定联合治疗策略(图 6-7)
通过细胞 + 动物实验,验证亚型特异性治疗机制与联合方案:
免疫治疗机制(C2 亚型):
细胞实验:C2 亚型细胞(OE33)PD-L1 表达更高,PD-L1 抗体(阿替利珠单抗)可诱导凋亡;STAT3 抑制剂(Stattic)+PD-L1 抗体联合治疗,可进一步增强凋亡、下调 PD-L1、抑制 EMT 和侵袭迁移(图6B-G);
动物实验:C2 亚型移植瘤对 PD-L1 抗体响应更显著,肿瘤生长抑制率更高(图 6D);
靶向治疗机制(C1 亚型):
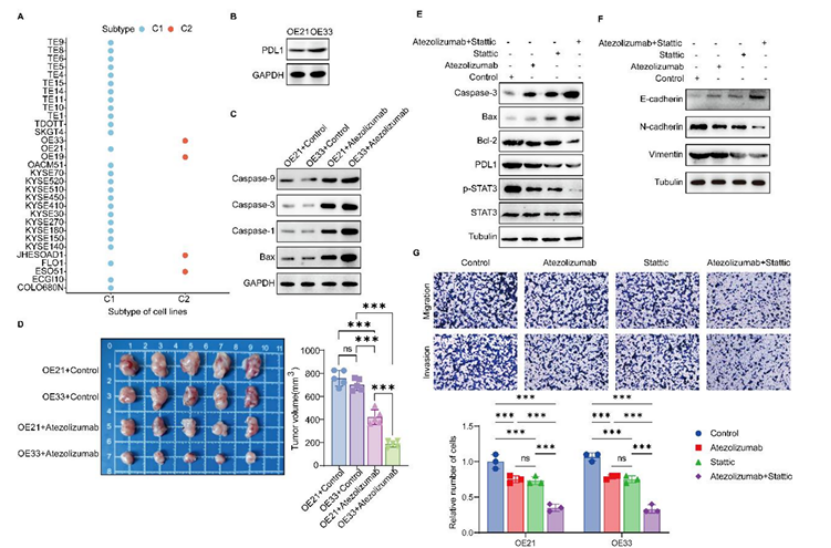
图6
分子验证:C1 亚型细胞(OE21)富集 Rap1 信号通路和糖酵解相关蛋白(HK2、PKM2)(图 7A-B);
功能实验:EGFR 抑制剂(吉非替尼)+ 糖酵解抑制剂(2-DG)联合治疗,可显著抑制 C1 亚型细胞集落形成(抑制率达 75%,图7C);
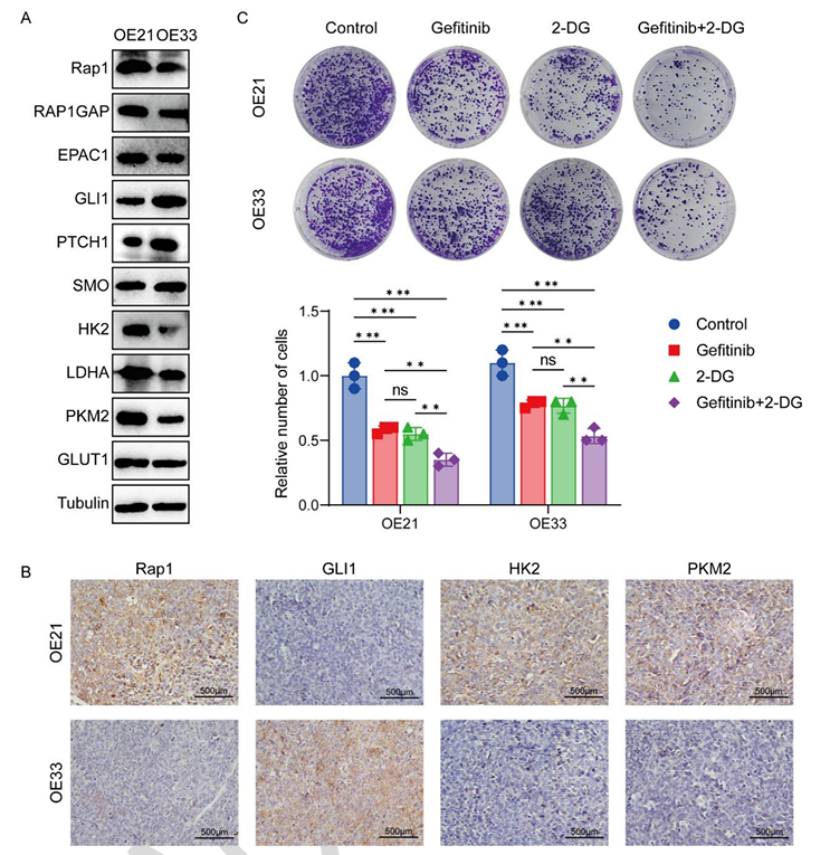
图7
医生发文启示:机制研究需“聚焦核心通路 + 联合治疗验证”,兼顾基因特征与药物效果,细胞实验(基因 / 药物干预)+ 动物实验(体内疗效)是顶刊认可的 “金标准”。
临床价值:
对临床医生:① 快速分层患者:通过微生物组 + 多组学特征,将患者分为 C1/C2 亚型,精准匹配治疗方案;② 治疗决策:C1 亚型优先选择化疗 + EGFR 抑制剂 / 糖酵解抑制剂,C2 亚型优先免疫治疗 + STAT3 抑制剂;③ 预后评估:C2 亚型预后差,需加强随访监测;
对科研人员:① 建立 “微生物组 - 多组学 - 亚型 - 治疗” 的研究范式;② 揭示假单胞菌 - STAT3 - 免疫微环境的互作网络,为后续机制研究提供靶点;
对患者:打破“一刀切” 治疗,C1 亚型患者避免无效免疫治疗,C2 亚型患者通过联合治疗提升响应率,延长生存期。
原文 DOI:10.1097/JS9.0000000000004503
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号