
来源:特诺科研
微卫星稳定型结直肠癌(MSS CRC)是免疫治疗的 “硬骨头”—— 占 CRC 的 85% 以上,却对 PD-1 抑制剂几乎无响应,患者复发风险高,核心耐药机制一直是临床难题。
近日,同济大学附属同济医院、复旦大学附属肿瘤医院团队联合在《Molecular Cancer》(肿瘤顶刊,IF=33.9,0 版面费)发表重磅成果:通过 “多组学 + 单细胞 + 体内外实验” 的完整闭环,首次建立基于免疫相关去泛素化酶(IR-DUBs)的 MSS CRC 分型体系,锁定核心靶点 USP7,证实其通过抑制 CXCL9/10/11 分泌阻断 CD8⁺T 细胞招募,而靶向 USP7 联合 PD-1 抑制剂能让 “冷肿瘤” 变 “热”,显著提升治疗效果!

文章信息速览
原标题:Immune-related deubiquitylation spectrum of microsatellite stability colorectal cancer reveals USP7 as a potential immunotherapeutic target
期刊:Molecular Cancer(IF=33.9,肿瘤顶刊,0版面费)
关键词:微卫星稳定型结直肠癌(MSS CRC)、USP7、免疫治疗耐药、去泛素化酶(DUBs)、单细胞测序、多组学、冷肿瘤热转化
研究背景与临床痛点
MSS CRC 的免疫治疗困境的临床 “老大难”:
占比高、响应差:85% 以上 CRC 为 MSS 型,PD-1 抑制剂单药响应率不足 5%,患者缺乏有效治疗方案;
机制模糊:已知 MSS CRC 是 “冷肿瘤”,但驱动免疫荒漠表型的核心分子和细胞机制一直不明确;
研究核心目标
① 筛选 MSS CRC 免疫相关去泛素化酶(IR-DUBs),建立具有临床意义的分子分型;② 挖掘调控免疫荒漠表型的核心靶点;③ 阐明靶点介导免疫耐药的分子机制;④ 验证靶点的临床转化价值,为 MSS CRC 免疫增敏提供新策略。
研究核心亮点:
这篇 IF=33.9 顶刊的精髓在于 “从临床问题出发,用多组学层层拆解,最后落地临床转化”,7 个核心步骤完美契合医生发文逻辑,每个步骤都有明确数据和图号支撑:
第一步:多队列筛选,锁定免疫相关去泛素化酶(IR-DUBs)(图 1)
研究先整合 TCGA+4 个 GEO 队列(共 1900 例 CRC 样本,1577 例 MSS),通过 8 种免疫浸润算法(ssGSEA、CIBERSORT 等)交叉验证,筛选出 22 个与 CD8⁺T/NK 细胞浸润强相关的 IR-DUBs(16 个负相关、6 个正相关),其中 USP7 在 MSS 与 MSI-H CRC 中突变频率差异最显著(16% vs 3%,P=5.29e-04,图 1E)。
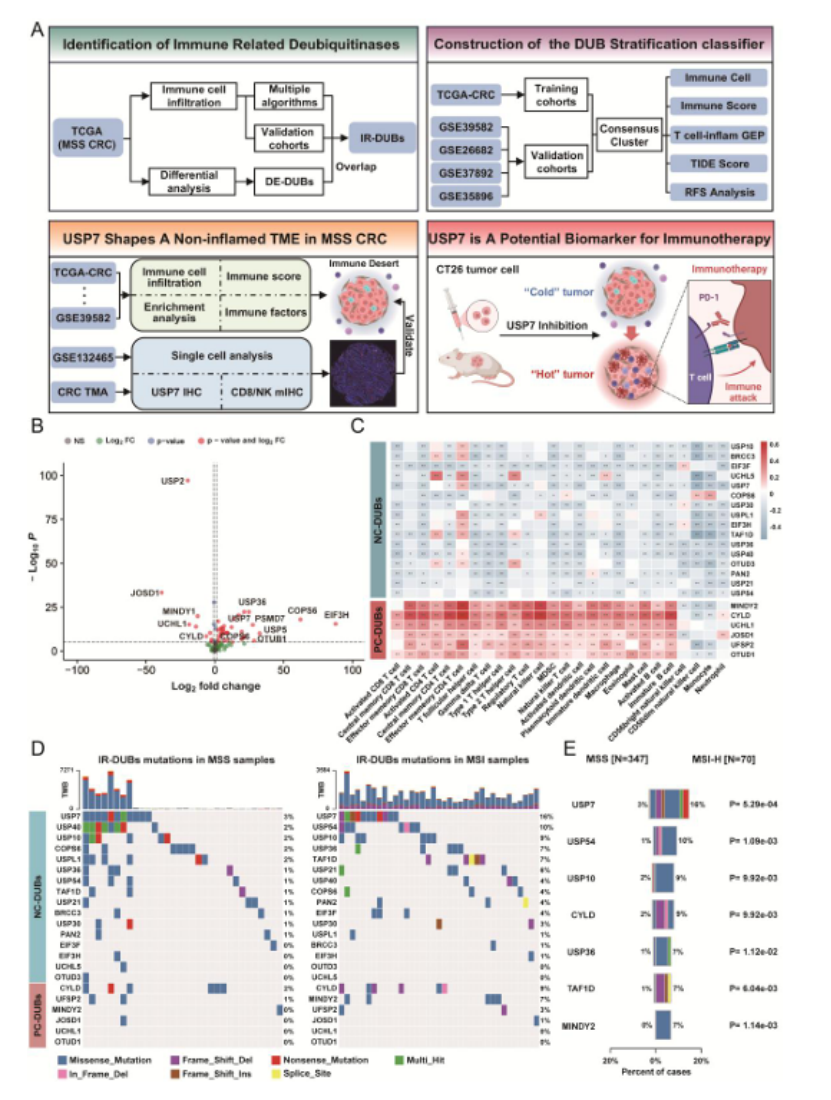
图1
医生发文启示:多算法 + 多队列验证是顶刊 “硬通货”,避免单一数据来源的偏倚,提升结果可靠性。
第二步:建立 DUB 分型体系,区分 “冷 / 热”MSS CRC(图 2)
基于 5 个核心负相关 IR-DUBs(USP7、USP10 等)进行共识聚类,将 MSS CRC 分为 DUB-H 和 DUB-L 两型:
DUB-L 型:免疫评分高、T 细胞炎症 GEP 评分高、TIDE 评分低,CD8⁺T/NK 细胞浸润丰富,复发 - free 生存(RFS)显著更长(图 2F),是 “热肿瘤” 表型;
DUB-H 型:免疫荒漠表型,细胞周期、血管生成通路激活,预后差;
验证:该分型在 5 个独立队列中稳定重现,且是独立预后因素(HR 值显著,图 2G)。
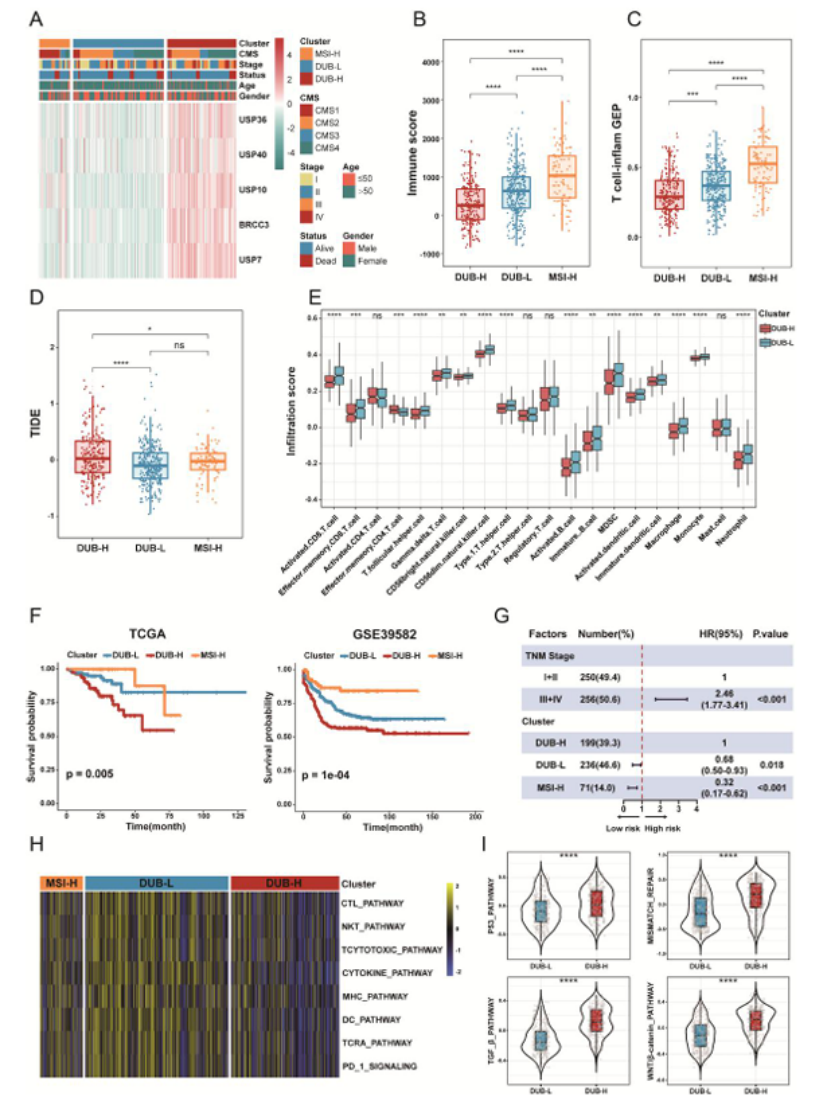
图2
医生发文启示:分子分型需结合免疫表型和预后价值,且要在多队列中验证稳定性,才能体现临床意义。
第三步:USP7 特异性高表达,是 MSS CRC 免疫耐药的核心靶点(图 3-4)
深入分析发现 USP7 是分型体系中的 “关键分子”:
表达特异性:MSS CRC 肿瘤组织中 USP7 显著高表达,而 MSI-H CRC 与正常组织无差异(图 3C-E),本地队列 IHC 验证一致(图 4D-E);
临床关联:USP7 高表达与 MSS 状态、CMS2 亚型、远端肿瘤位置显著相关(图 4B、F),且 MSS CRC 患者 USP7 低表达组总生存期显著更长(图 4G);
免疫相关性:USP7 表达与 CD8⁺T/NK 细胞浸润、免疫评分、IFN-γ 信号呈强负相关(图 3A-B、I-J),且与 MMR 基因(MLH1、MSH2 等)正相关。
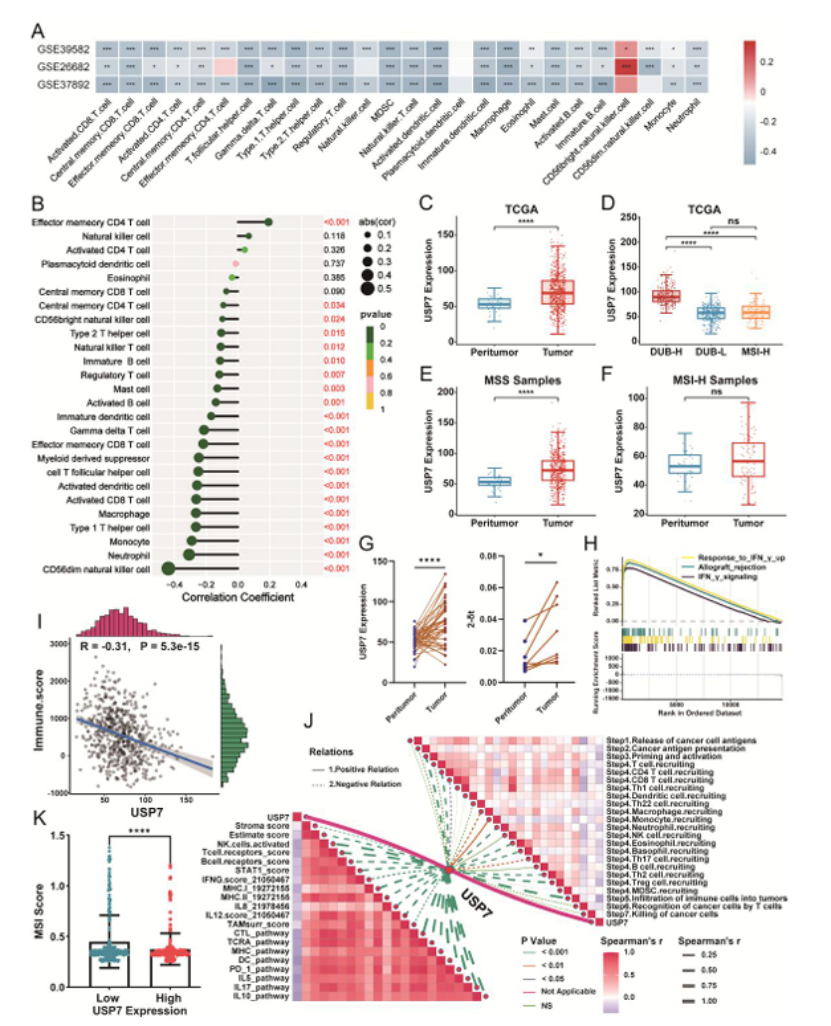
图3
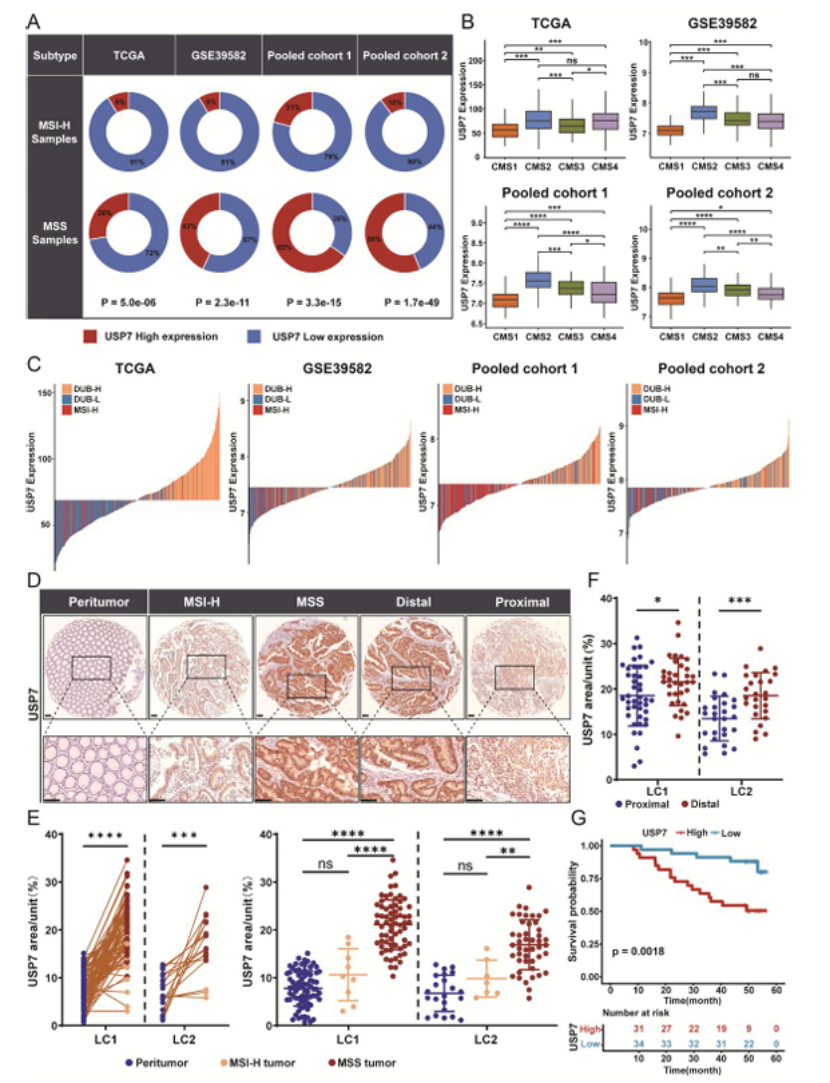
图4
医生发文启示:靶点选择需满足“表达特异性 + 临床关联 + 免疫相关性”,多维度交叉验证提升靶点可信度。
第四步:单细胞 + 多重免疫荧光,实锤 USP7 介导免疫荒漠表型(图 5)
用单细胞 RNA-seq(GSE132465)和多重免疫荧光(mIF)验证机制:
单细胞分析:USP7 高表达样本中上皮细胞占比高,CD8⁺T/CD4⁺T 细胞、髓系细胞富集度低,细胞间通讯弱(图 5B-D);
mIF 验证:USP7 高表达的 MSS CRC 中,CD3⁺CD8⁺T 细胞、CD3⁻CD56⁺NK 细胞、GZMB⁺功能细胞比例显著降低(图 5F、H-I),且 USP7 主要定位于肿瘤上皮细胞,与免疫细胞空间排斥(图 5G);
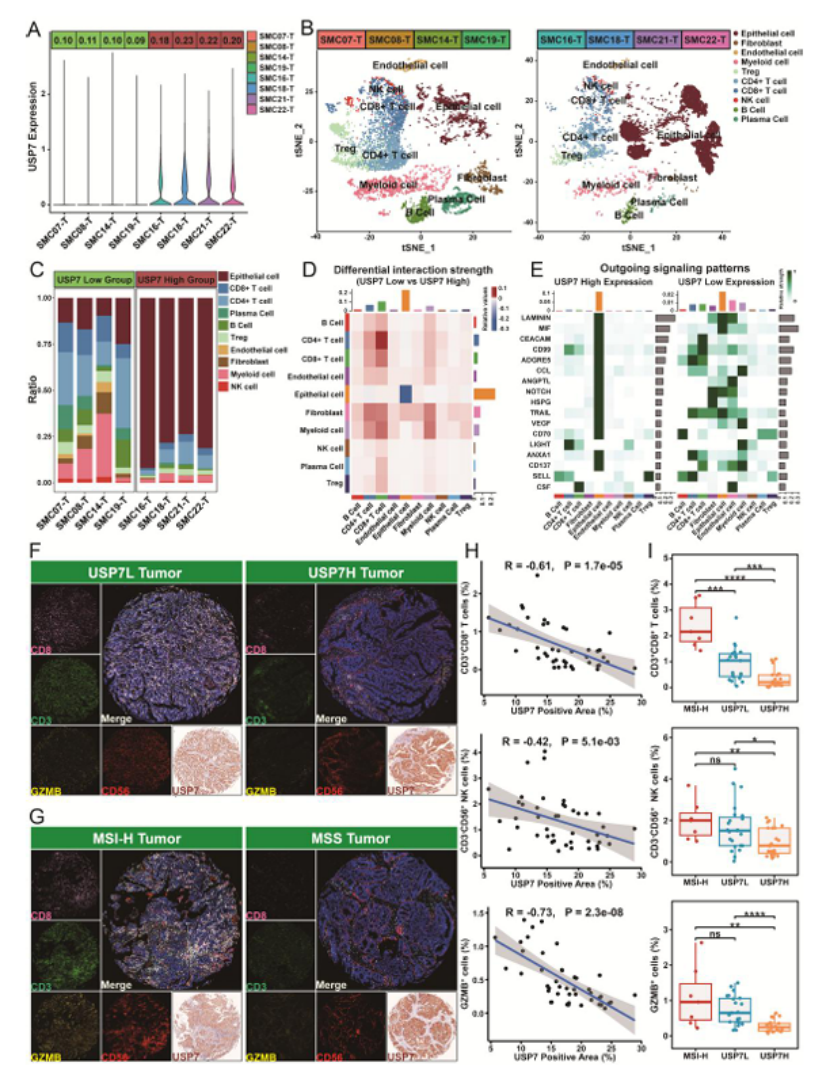
图5
医生发文启示:单细胞 + 空间 / 多重免疫荧光是验证 “分子 - 细胞 - 表型” 关联的关键技术,顶刊高度青睐这种 “从宏观到微观” 的验证逻辑。
第五步:体外机制验证,USP7 通过抑制 CXCL9/10/11 阻断 T 细胞招募(图 6)
细胞实验明确分子机制:
分泌组分析:USP7 敲低后,MSS CRC 细胞(SW480、SW1116)分泌 CXCL9/10/11 等 T 细胞招募趋化因子显著增加(图 6A);
通路验证:USP7 敲低激活 IFN-γ 信号和 T 细胞介导的免疫通路(图 6E-F);
功能实验:USP7 敲低或抑制剂(P5091)处理后,CD8⁺T 细胞迁移能力增强,分泌 IFN-γ、GZMB、TNF-α 增加,T 细胞介导的肿瘤杀伤效率显著提升(图 6H-L)。
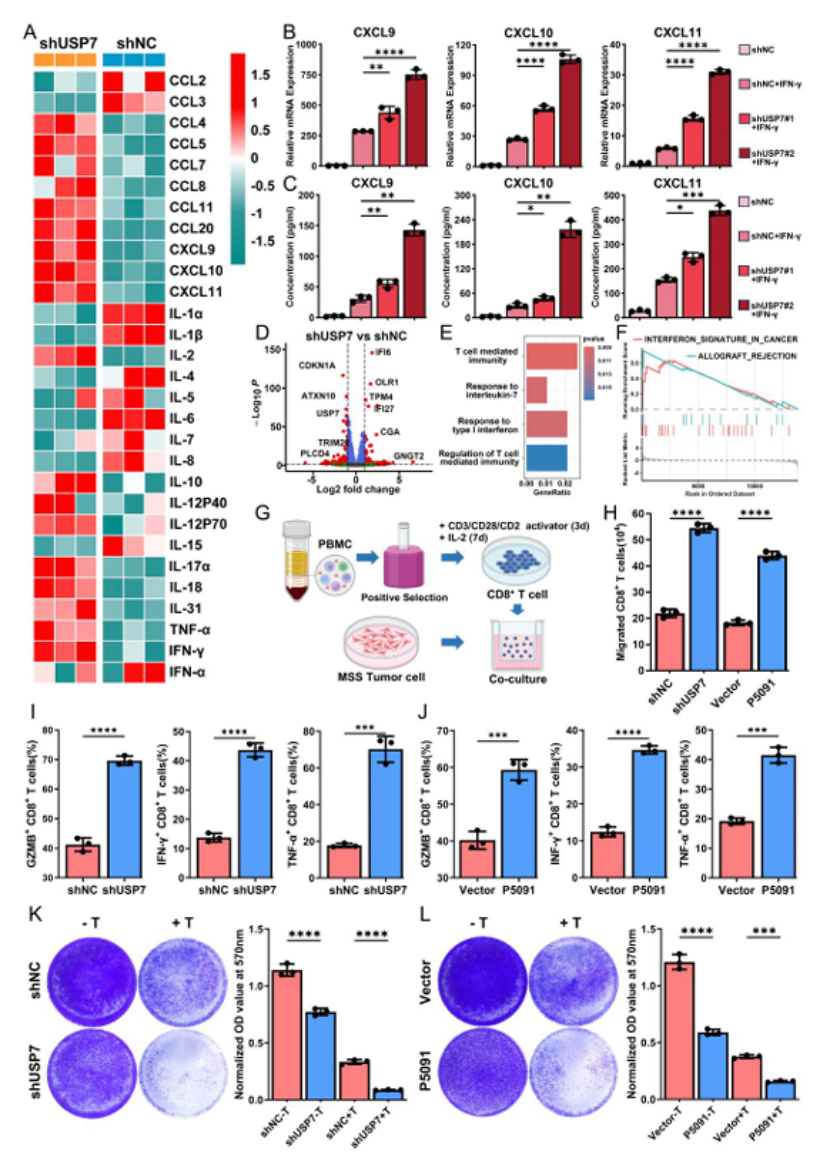
图6
医生发文启示:机制研究需聚焦“核心通路 + 功能验证”,从 “分泌 - 招募 - 激活 - 杀伤” 形成完整链条,实验设计要兼顾基因敲低和药物抑制,提升转化价值。
第六步:体内实验证实,USP7 抑制剂联合 PD-1 抑制剂显著增敏(图 7-8)
动物实验验证治疗效果:
基因敲低模型:USP7 敲低 + 抗 PD-1 联合治疗,CT26 荷瘤小鼠肿瘤体积显著缩小,生存期延长,肿瘤内 CD8⁺T/NK 细胞浸润和功能增强(图 7B-G、H-Q);
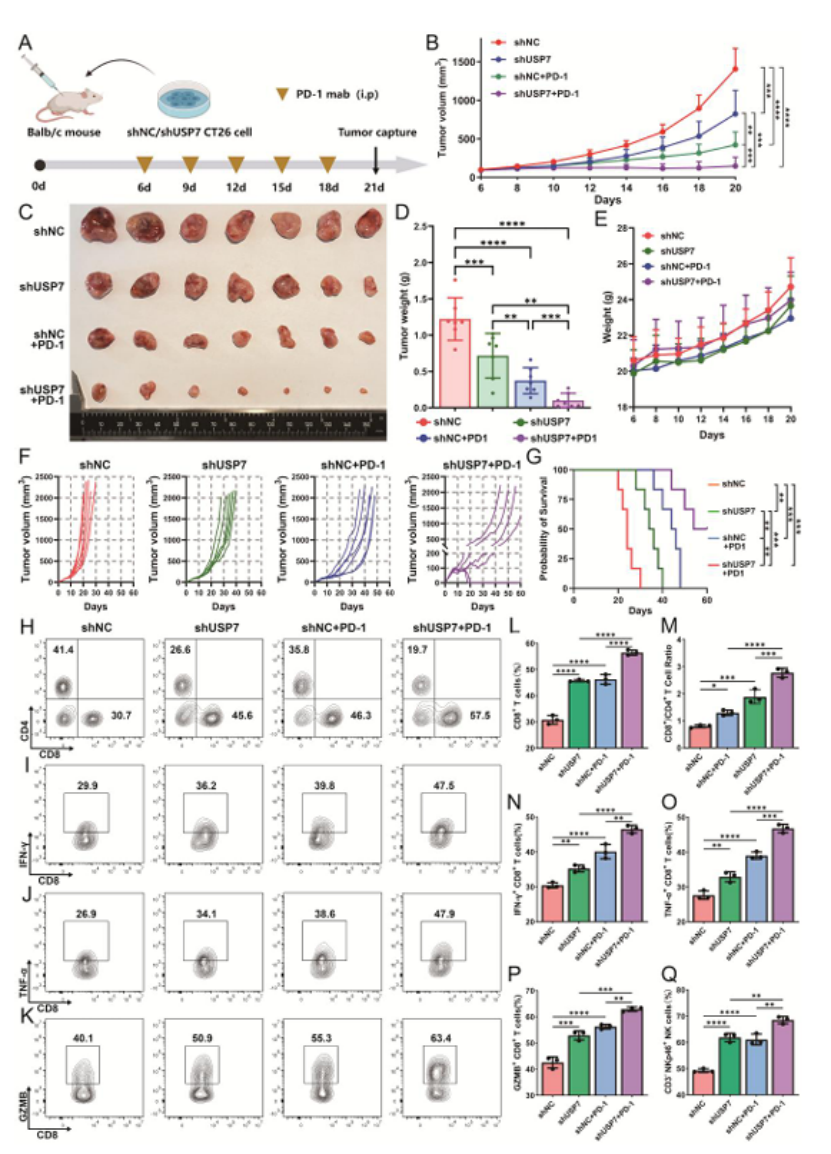
图7
药物联合模型:USP7 抑制剂 P5091 + 抗 PD-1 治疗,同样显著抑制肿瘤生长,增加 CD8⁺T/NK 细胞浸润,且对脾脏免疫细胞组成有系统性调控作用(图 8B-G、H-M);
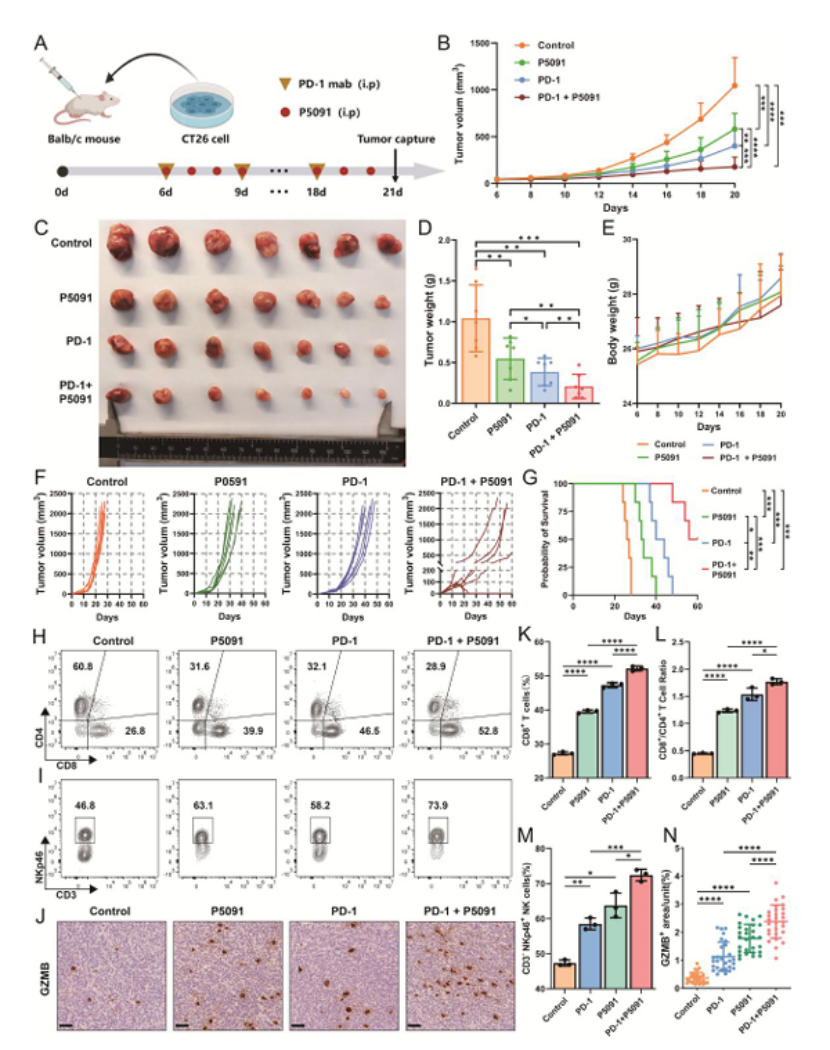
图8
交叉验证:在 MSI-H MC38 模型中,P5091 也能抑制肿瘤生长,但效果弱于 MSS 模型(图 S9J-N),证实靶点特异性。
医生发文启示:体内实验需设置“单药 + 联合” 分组,重点关注免疫微环境重塑效果,为临床联合用药提供直接依据,是顶刊必备的转化证据。
第七步:临床关联验证,USP7 低表达预测免疫治疗响应(图 9)
小样本临床队列初步验证:
10 例接受抗 PD-1 治疗的晚期 MSS CRC 患者中,免疫治疗响应者(PR)的 USP7 表达显著低于无响应者(SD/PD)(图 9A-B);
USP7 低表达患者总生存期更长(图 9C),提示 USP7 可作为 MSS CRC 免疫治疗响应的预测标志物。
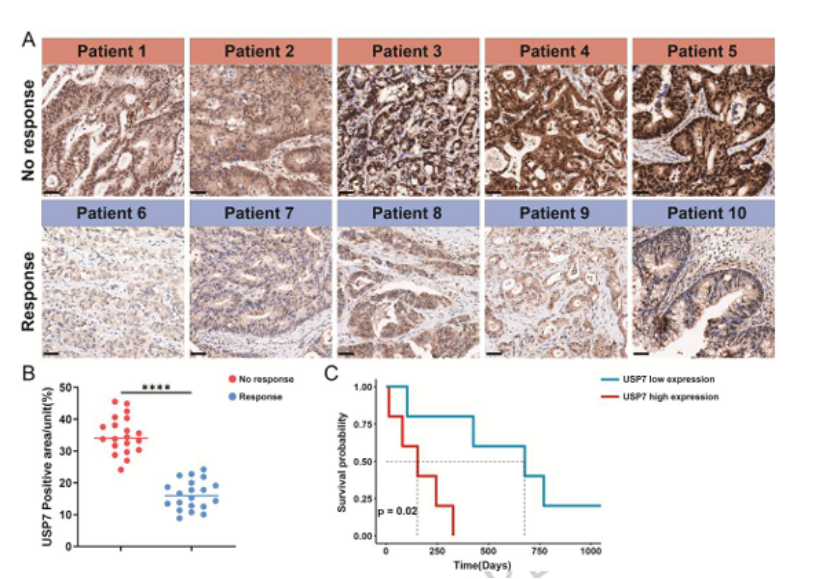
图9
医生发文启示:即使是小样本临床队列,也能显著提升论文的临床转化价值,顶刊重视“基础 - 临床” 的衔接。
临床价值:
对临床医生:① DUB 分型可精准分层 MSS CRC 患者,DUB-L 型可能直接受益于免疫治疗,DUB-H 型需联合 USP7 抑制剂;② USP7 可作为免疫治疗响应的预测标志物(IHC 可检测),帮助筛选获益人群;③ 提供新治疗方案:USP7 抑制剂 + PD-1 抑制剂,为 MSS CRC 患者带来新希望。
对科研人员:① 建立 “IR-DUBs - 免疫表型 - 预后” 的关联体系,为 CRC 免疫分型提供新视角;② 阐明 USP7-CXCL9/10/11-CD8⁺T 细胞招募的核心机制,丰富 “冷肿瘤” 热转化的理论;
对患者:MSS CRC 不再是免疫治疗 “禁区”,USP7 靶向联合免疫治疗有望显著提升响应率,延长生存期。
总的来说,这篇 IF=33.9 的顶刊,示范了临床医生做多组学研究的核心逻辑:
选题:临床痛点(MSS CRC 免疫耐药)+ 技术创新(IR-DUBs 分型 + 多组学整合)+ 转化价值(靶点 + 联合治疗方案);
逻辑:多队列筛选(IR-DUBs)→ 分子分型(DUB-H/L)→ 靶点锁定(USP7)→ 机制解析(单细胞 + 体外实验)→ 体内验证(联合治疗)→ 临床关联(响应预测);
加分:多技术交叉(多组学 + 单细胞 + 空间验证)+ 实验闭环(基因敲低 + 药物抑制 + 体内外)+ 临床落地(分型 + 标志物 + 治疗方案)。
对于手握临床样本的医生来说,不用追求复杂技术堆砌,而是要围绕一个明确的临床问题,用多组学技术层层拆解核心分子和机制,再通过“体外 - 体内 - 临床” 的实验闭环验证,就能更好地写出顶刊认可的好论文。
原文 DOI: 10.1186/s12943-025-02502-8
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号