
来源:特诺科研
急性心肌梗死(AMI)多支血管病变患者接受完全血运重建后,仍有 20% 左右会出现心力衰竭、心源性死亡等不良结局,心肌缺血再灌注(MI/R)损伤是核心诱因,但潜在机制与精准干预靶点一直未被明确。
近日,由北京安贞医院、首都医科大学等多中心联合团队在《Cell Reports Medicine》(IF=10.6,医学顶刊,开源获取)发表重磅研究:通过多中心临床队列、大动物模型、多组学分析及细胞实验,首次证实长链酰基肉碱(LCAC)积累是血运重建后心肌损伤的关键驱动因素,锁定 LCAC C16:1 为预后标志物,揭示“内皮 CPT1A 激活→LCAC 释放→OCTN2 介导心肌细胞摄取→线粒体稳态失衡”的核心机制,且 CPT1A 抑制剂依托莫昔(Etomoxir)可有效干预,为高风险患者的精准管理提供全新方案。

图1 文献信息
文章信息速览
原标题:Targeting long-chain acylcarnitine accumulation to protect cardiac mitochondrial homeostasis after complete revascularization
期刊:Cell Reports Medicine(IF=10.6,开源获取)
关键词:急性心肌梗死(AMI)、多支血管病变、完全血运重建、缺血再灌注损伤、长链酰基肉碱(LCAC)、CPT1A、线粒体稳态、依托莫昔(Etomoxir)、预后标志物
研究背景
50% 以上 AMI 患者合并多支血管病变,完全血运重建(开通罪犯血管 + 非罪犯血管)是标准治疗,但 18%-20% 患者仍发生心力衰竭、心源性死亡,缺血再灌注损伤是主要元凶;
诊断缺口:缺乏有效的术前风险分层标志物,无法精准识别高风险患者,导致治疗决策“一刀切”;非罪犯血管再灌注损伤的独特机制未被阐明,传统针对单一血管的研究无法模拟临床复杂场景;尚无靶向缺血再灌注损伤的有效药物,现有治疗仅能对症支持,无法阻断核心病理过程。
研究核心目标
① 筛选完全血运重建后不良预后的代谢标志物;② 解析非罪犯血管再灌注损伤的关键分子机制;③ 验证靶向通路的干预效果,为临床转化提供依据。
研究核心亮点(顶刊级“临床 - 动物 - 细胞 - 机制 - 干预” 完整链条)
这篇顶刊研究的成功关键在于“从临床问题出发,用多模型验证,从标志物到干预靶点的全链条解析”,5 大核心步骤完美契合医学顶刊逻辑,科研人员可直接借鉴:
1. 第一步:多中心临床队列,锁定 LCAC C16:1 为预后标志物
研究设计:纳入416 例 AMI 多支血管病变患者,分为筛选队列(39 例)、推导队列(216 例)、验证队列(161 例),随访中位 44.1 个月,记录 MACE(全因死亡、心力衰竭再住院);
核心发现:① 非靶向代谢组筛选出 LCAC 家族是差异最显著的代谢物,其中 LCAC C16:1 在不良结局组升高最显著;② 多因素 Cox 回归显示,LCAC C16:1 是 MACE 的独立危险因素(HR=2.32);③ Kaplan-Meier 分析证实,高 LCAC C16:1(>90 nM)患者预后显著更差(log rank p<0.05);④ 联合 LCAC C16:1 与 SYNTAX/GRACE 评分,预测效能显著优于单一评分;
临床意义:首次提供可用于术前风险分层的无创代谢标志物,助力精准筛选高风险患者。
2. 第二步:大动物模型(小型猪),揭示内皮 CPT1A 的核心作用
模型构建:建立广西巴马小型猪AMI 多支血管病变模型,左前降支(罪犯血管)完全闭塞,左回旋支(非罪犯血管)70% 狭窄,分别进行 “完全血运重建”(同时开通两支血管)和 “仅开通罪犯血管” 对照(图 2);
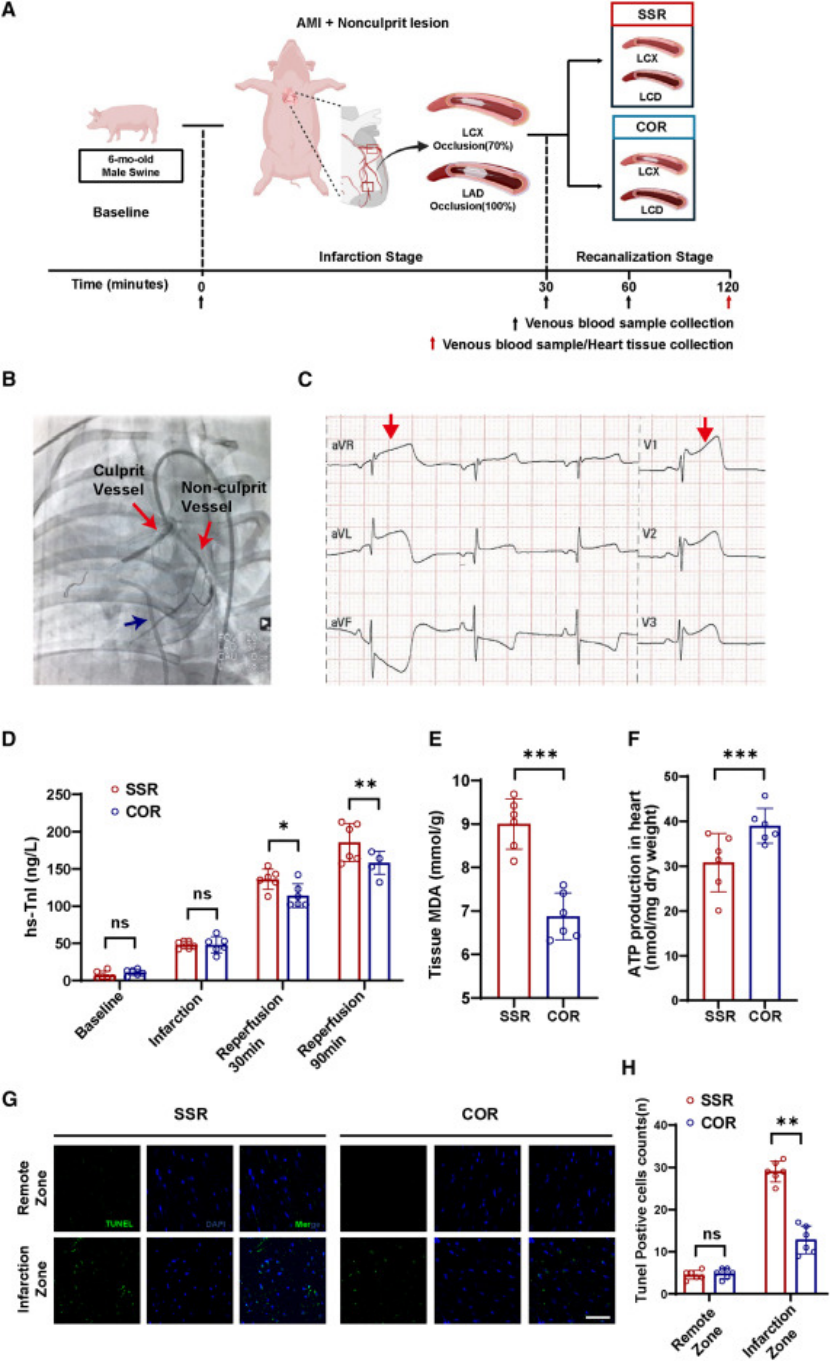
图2
关键发现:① 完全血运重建组心肌损伤更严重,表现为心肌酶升高、ATP 减少、凋亡增加(图 2D-H);② 多组学分析(代谢组 + 蛋白质组)显示,脂代谢通路激活,CPT1A(肉碱棕榈酰转移酶 1A)是 LCAC 代谢的核心调控因子(图3);③ 免疫荧光证实,CPT1A 主要表达于内皮细胞(而非心肌细胞),血流剪切应力是其激活的关键诱因(图 3H);
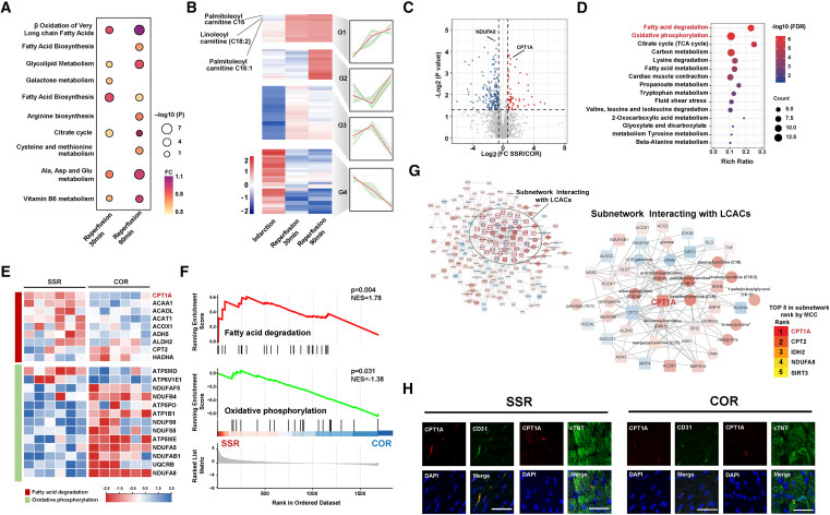
图3
机制突破:颠覆“心肌细胞自身代谢紊乱” 的传统认知,明确非罪犯血管再灌注时,内皮细胞是 LCAC 释放的主要来源。
3. 第三步:体外细胞实验,验证 LCAC 进入心肌细胞的通路
细胞模型:人脐静脉内皮细胞(HUVEC)+ 大鼠成年心肌细胞(ACMs)共培养,模拟内皮 - 心肌细胞 Crosstalk;
核心验证:① 血流剪切应力刺激内皮细胞后,CPT1A 表达升高,培养液中 LCAC C16:1 浓度显著增加;② 沉默 CPT1A 或用依托莫昔抑制后,LCAC 释放被阻断(图 4);③ 分子对接证实,LCAC 与 OCTN2(有机阳离子转运体 2)结合亲和力高(结合能 - 6.5 kcal/mol);④ 抑制 OCTN2 可减少心肌细胞对 LCAC 的摄取,减轻线粒体损伤(图 5);
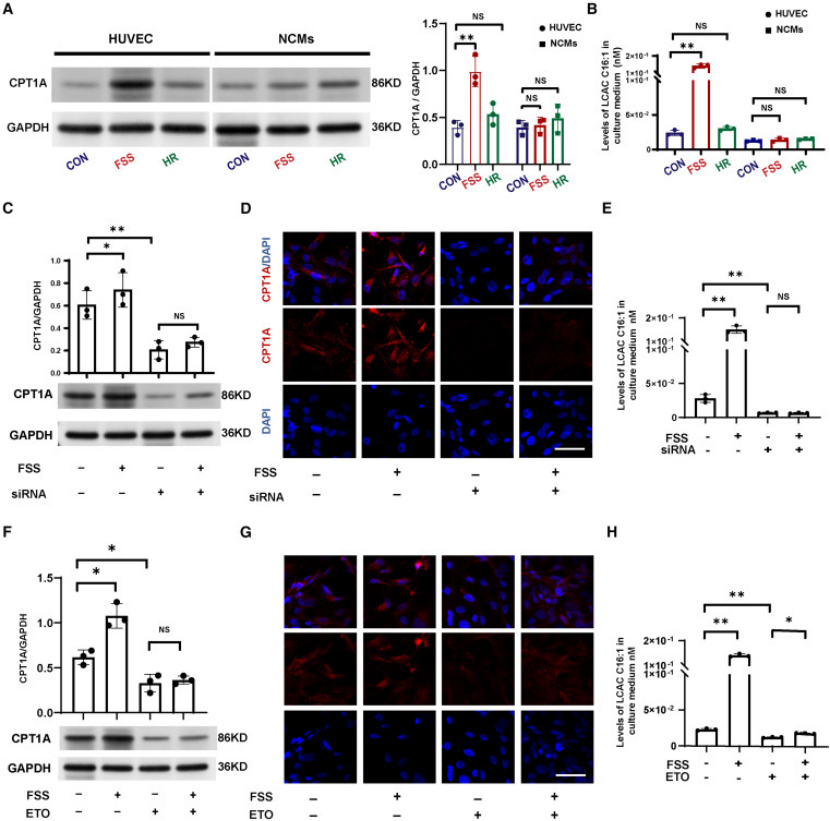
图4
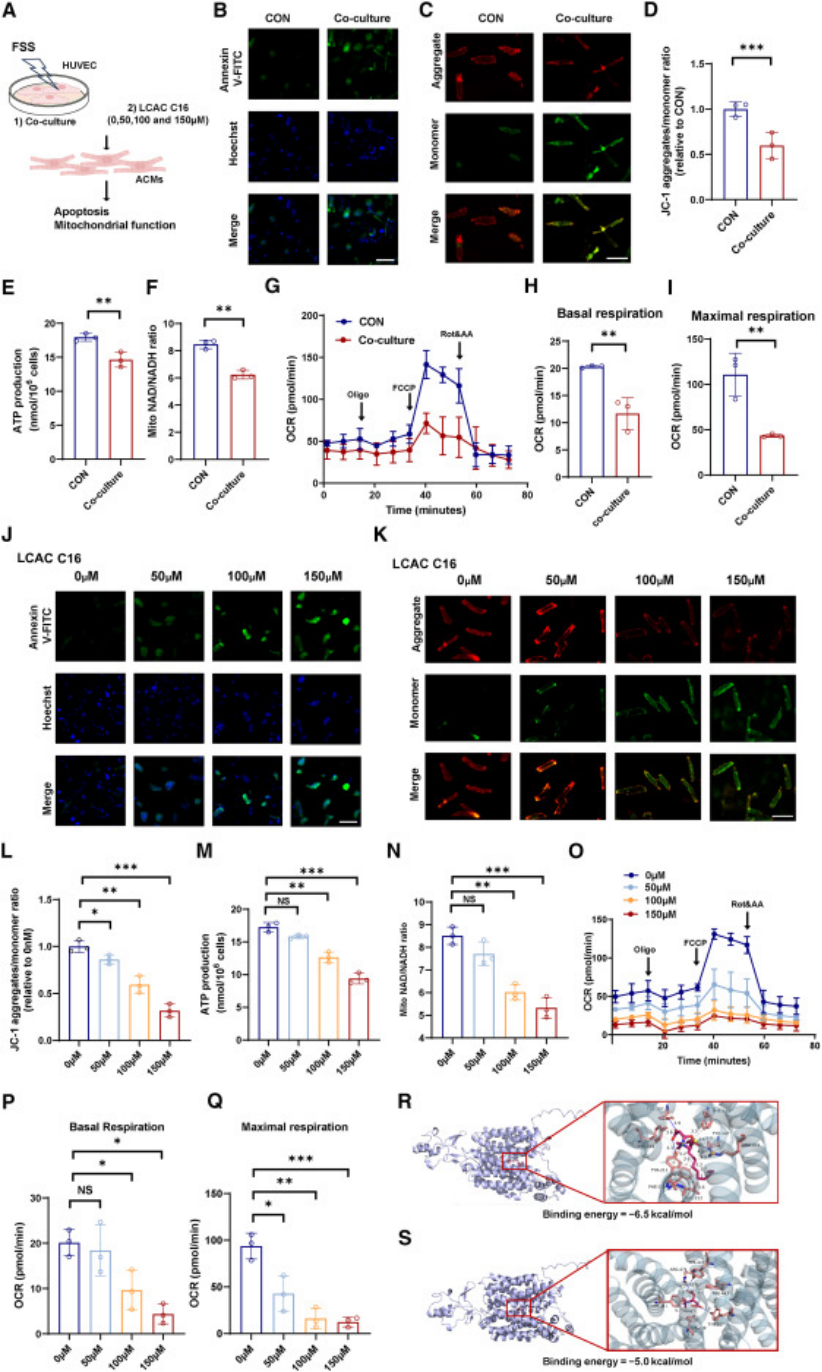
图5
关键结论:OCTN2 是 LCAC 进入心肌细胞的关键转运体,为双靶点干预(CPT1A+OCTN2)提供依据。
4. 第四步:机制深挖,LCAC 通过抑制 PGC-1α 破坏线粒体稳态
转录组分析:高浓度LCAC 处理心肌细胞后,线粒体相关基因(Mt-co1、Mt-cyb 等)显著下调,氧化磷酸化通路受抑(图 6);
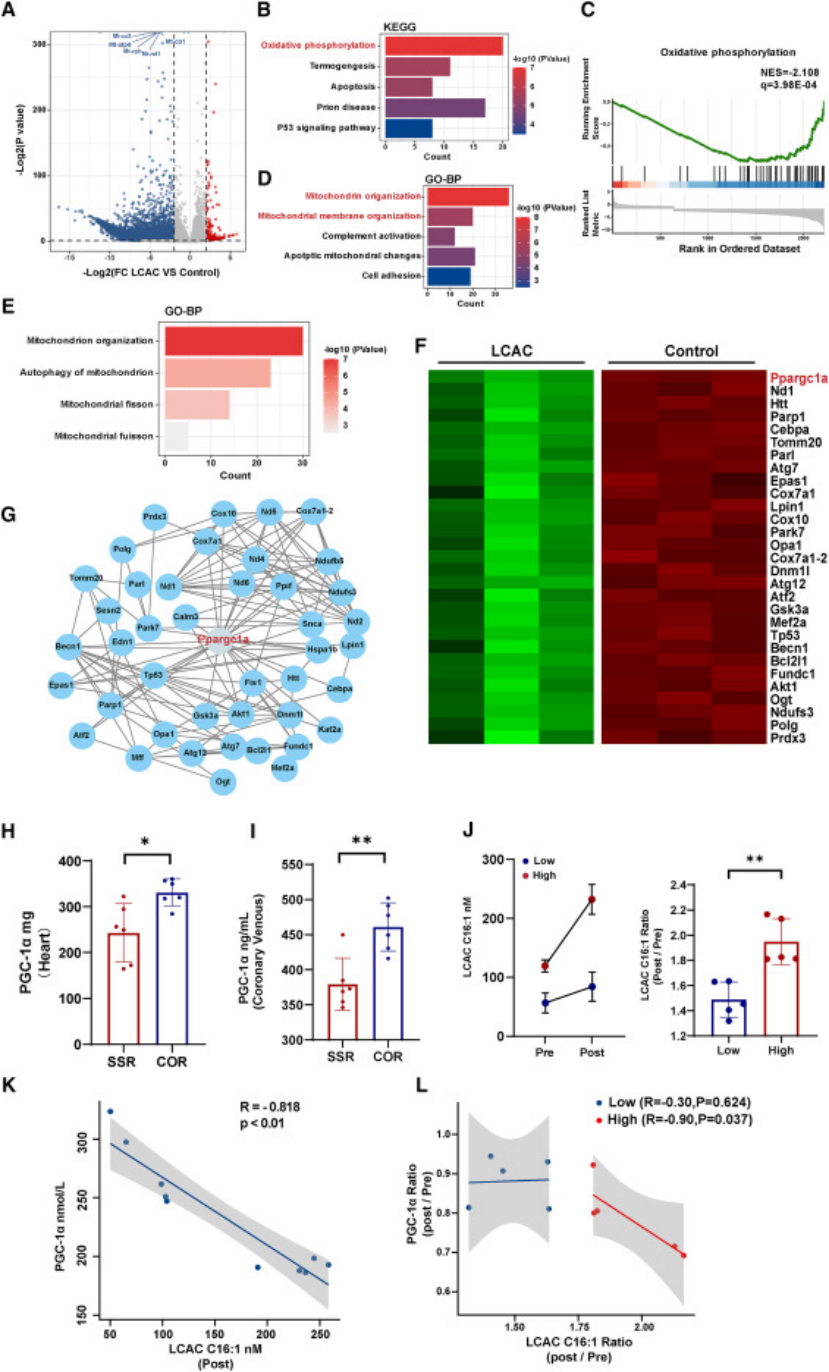
图6
核心机制:① LCAC 抑制 PGC-1α(过氧化物酶体增殖物激活受体 γ 辅激活因子 1α)表达,而 PGC-1α 是线粒体生物合成与质量控制的核心调控因子;② 临床样本验证:术后 LCAC C16:1 水平与 PGC-1α 表达呈负相关(图 6K-L);③ 线粒体功能检测显示,LCAC 处理后心肌细胞线粒体膜电位下降、ATP 生成减少、呼吸功能受损(图 5);
逻辑闭环:内皮细胞释放LCAC → OCTN2 介导心肌细胞摄取 → 抑制 PGC-1α → 线粒体稳态失衡 → 心肌细胞凋亡。
5. 第五步:小鼠模型验证,依托莫昔精准干预改善预后
干预实验:小鼠LAD 结扎建立 MI/R 模型,分为对照组、LCAC 补充组、依托莫昔处理组;
核心结果:① 依托莫昔组心肌组织 LCAC 积累减少,线粒体形态改善( cristae 完整,肿胀减轻)(图 7B);② 心功能评估:左心室射血分数(EF)、短轴缩短率(FS)显著高于对照组,心肌肥厚与纤维化程度减轻(图 7E-K);③ LCAC 补充组则加重心肌损伤,进一步证实 LCAC 的致病作用;
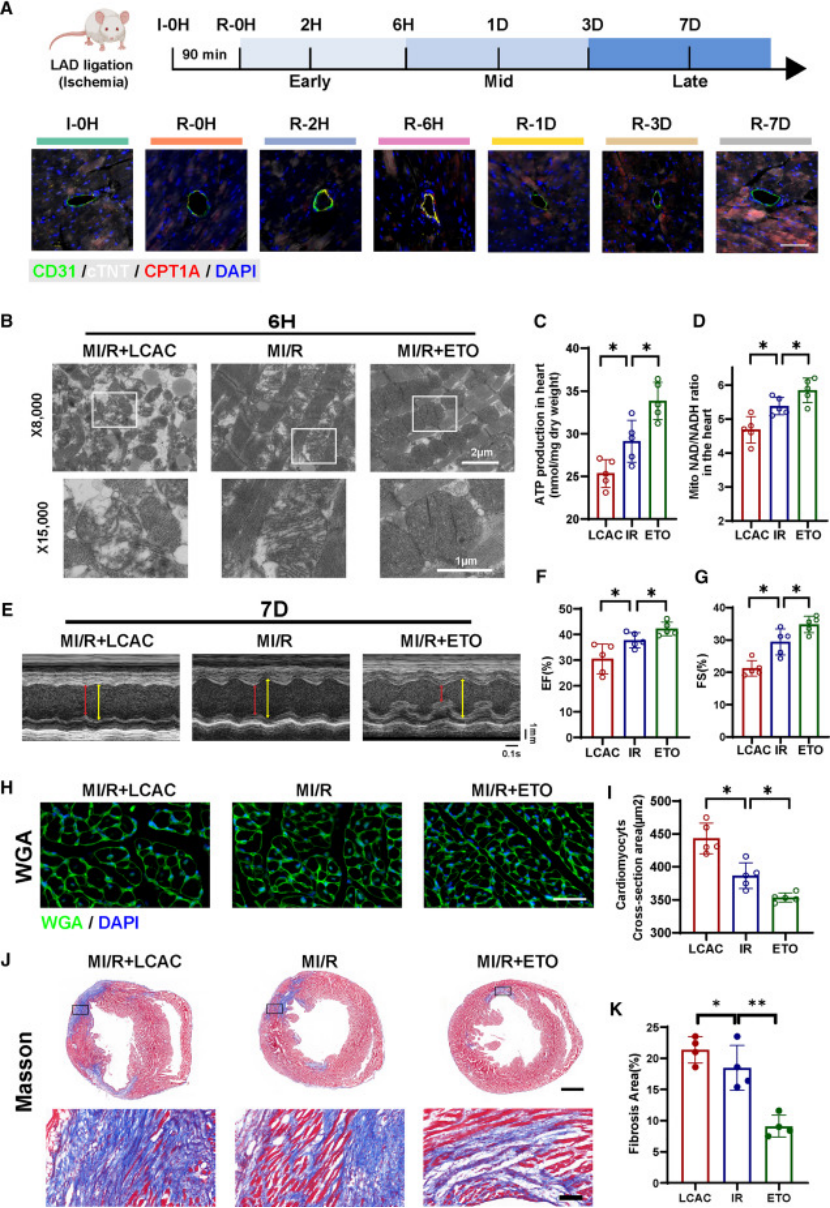
图7
临床转化:依托莫昔作为已开展临床研究的CPT1A 抑制剂,短期使用安全性可控,为急性心肌梗死术后高风险患者提供了潜在治疗方案。
多模型验证+ 全链条解析,破解心梗血运重建后心肌损伤难题
北京安贞医院牵头的多中心联合团队,通过“临床队列筛选标志物 - 大动物模型模拟病理过程 - 细胞实验解析分子机制 - 动物实验验证干预效果” 的闭环研究,首次明确 “长链酰基肉碱(LCAC)积累” 是 AMI 多支血管病变患者完全血运重建后心肌损伤的核心元凶,揭示了 “内皮 CPT1A 激活→LCAC 释放→OCTN2 介导摄取→PGC-1α 抑制→线粒体稳态失衡” 的完整通路,验证了 CPT1A 抑制剂依托莫昔的治疗潜力。
研究不仅填补了非罪犯血管再灌注损伤机制的研究空白,更提供了可直接落地的“风险分层标志物 + 靶向干预方案”,为心梗患者的精准治疗开辟了新路径。对于科研人员而言,这篇研究的 “多中心 + 多模型 + 多组学 + 机制 + 干预” 思路,是冲刺医学顶刊的黄金模板 —— 从临床痛点切入,用多层次证据链验证,最终回归临床应用,完美契合转化医学的研究逻辑。
原文DOI: 10.1016/j.xcrm.2025.102507
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号