
来源:特诺科研
各位妇科肿瘤医生是不是也遇到过:HPV 阴性宫颈癌明明转移率高、死亡率高(占比 3%-8%),但治疗方案却和 HPV 阳性患者没区别?核心问题就在于 —— 我们没摸清这两类宫颈癌的免疫微环境到底差在哪,尤其是细胞的空间分布和互作机制。
今天要拆解的哈医大肿瘤医院团队研究,就用“单细胞 RNA-seq + 空间转录组 + bulk RNA-seq” 三组合拳,把 HPV 阳性 / 阴性宫颈癌的免疫微环境差异扒得明明白白:从超分辨空间图谱定位细胞位置,到 CD8+T 细胞分化轨迹找功能差异,再到锁定上皮细胞调控免疫的关键通路,最后还建了个能预测预后和免疫治疗响应的模型。想做宫颈癌多组学研究、或者需要数据挖掘 / 模型构建支持的医生,这篇的框架直接参照!

文章信息速览
原标题:Integrated multi-omics analysis of single-cell and spatial transcriptomics reveals distinct hpv-associated immune microenvironment features and prognostic signatures in cervical cancer
期刊:Frontiers in Oncology(IF=5.9)
关键词:多组学、宫颈癌(CC)、HPV 状态、单细胞测序、空间转录组、免疫微环境(TME)、CD8+T 细胞分化轨迹、上皮细胞相关预后模型(ERS)、ANXA1-FPR1/3 通路、MDK-LRP1 通路
研究背景与目的
宫颈癌的核心致病因素是高危 HPV 持续感染,但 HPV 阴性患者预后更差(晚期转移率高、死亡率高),目前却没有针对性治疗方案 —— 关键原因是 “HPV 正负宫颈癌的免疫微环境异质性” 没搞清楚:
免疫细胞(比如 CD4+T、CD8+T、DC 细胞)的比例和功能有啥差异?
这些细胞在组织里的空间位置怎么分布,怎么互作?
能不能找到能预测预后的标志物,甚至指导治疗?
这篇研究就用多组学技术解决这些问题,最终还建了个上皮细胞相关预后模型(ERS),为 HPV 分层治疗提供依据。
研究亮点
这篇文章最值得学的是“从‘空间定位’到‘功能机制’再到‘临床应用’的完整逻辑链”,每一步都紧扣 “HPV 状态差异”,我们分5 点拆:
1. 超分辨空间图谱:先摸清细胞 “住在哪”(解决空间异质性问题)
普通空间转录组(如 10X Visium)每个 spot 含 25 + 细胞,分辨率不够?研究用iStar 算法(整合 HE 染色和空间转录组数据),构建了近单细胞分辨率的宫颈癌组织图谱,清晰看到不同细胞的空间分布(图 1B):
不管 HPV 阳性还是阴性,记忆 B 细胞都紧邻 naive B 细胞、DC 细胞紧邻 CD4+T 细胞(图 1F、G)—— 这为 “B 细胞分化”“DC 细胞呈递抗原给 CD4+T 细胞” 提供了空间证据;
还发现 HPV 阴性患者特有的成纤维细胞亚型(fibroblast4),可能和 HPV 阴性肿瘤的侵袭性相关(图 1B)。
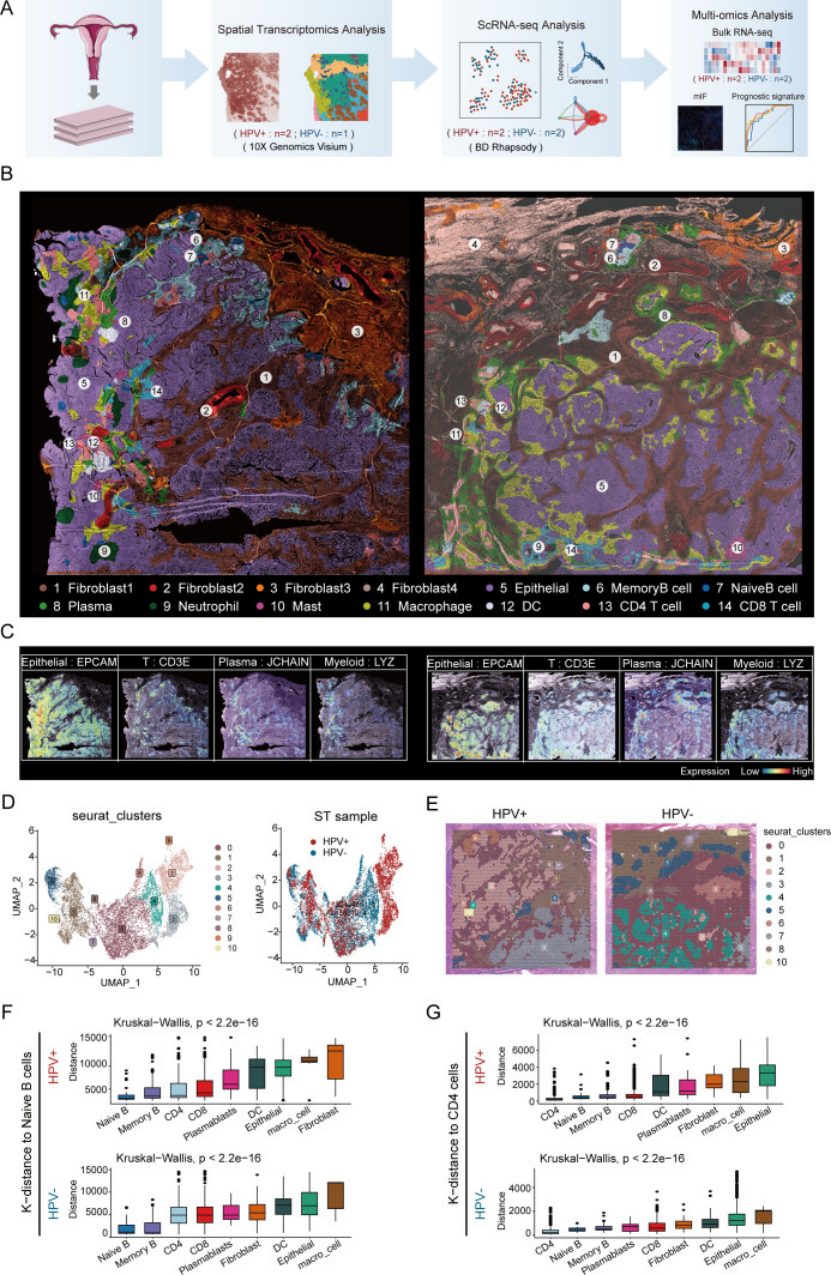
这步提醒医生:做空间转录组别只满足“看基因表达”,用算法提升分辨率,结合细胞位置分析互作可能性,可信度更高。
2. 单细胞分群:再看细胞 “多不多、是啥型”(锁定免疫差异核心)
研究对 4 例宫颈癌样本(2 例 HPV+、2 例 HPV-)做单细胞测序,共 8843 个细胞,分 7 大群,重点对比免疫细胞差异(图 2A-C):
HPV 阳性样本:CD4+T 细胞(包括 naive CD4+T、Treg)和 cDC2 细胞(常规树突状细胞 2 型)比例更高(图 2F、G);
HPV 阴性样本:CD8+T 细胞(除了干扰素相关 CD8+T)比例更高,还有更多巨噬细胞、单核细胞(图 2F、G);
TCGA cohort 验证:结果和单细胞一致,HPV + 患者 cDC2 浸润多,HPV - 患者 CD8+T 多(图 2G 右)。
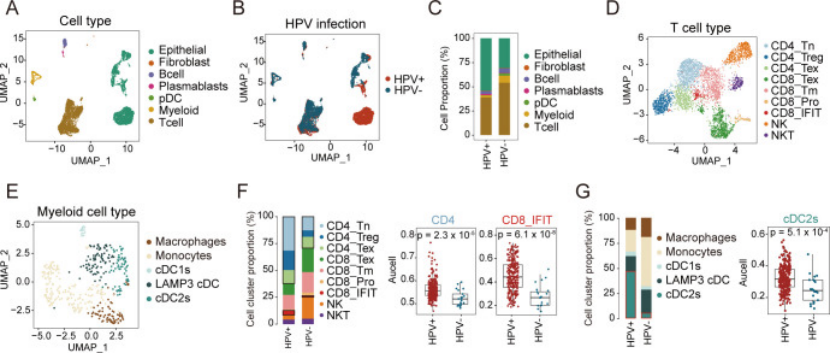
这步说明:HPV 状态直接影响免疫细胞组成 ——HPV + 靠 CD4+T 和 cDC2 介导免疫,HPV - 靠 CD8+T,但后续发现这些 CD8+T 功能并不好。
3. CD8+T 细胞轨迹:深挖细胞 “功能好不好”(找到预后差异关键)
既然 HPV 阴性患者 CD8+T 多,为啥预后还差?研究用 Monocle2 做 CD8+T 细胞伪时间轨迹,发现两类患者的 CD8+T 分化路径完全不同(图 3A-D):
HPV 阳性患者:CD8+T 走 “Fate1 路径”,从记忆 CD8+T 分化为干扰素相关 CD8+T(高表达 STAB1、TRIM22)——STAB1 能调节炎症、TRIM22 是抗病毒基因,这路 CD8+T 是 “有功能的”(图 3E-G);
HPV 阴性患者:CD8+T 走 “Fate2 路径”,分化为耗竭 CD8+T 和增殖 CD8+T(高表达 BHLHE40、RBPJ)——BHLHE40 促进 T 细胞耗竭,RBPJ(Notch 信号)抑制 CD8+T 细胞毒性,这路 CD8+T 是 “没功能的”(图 3E-G)。
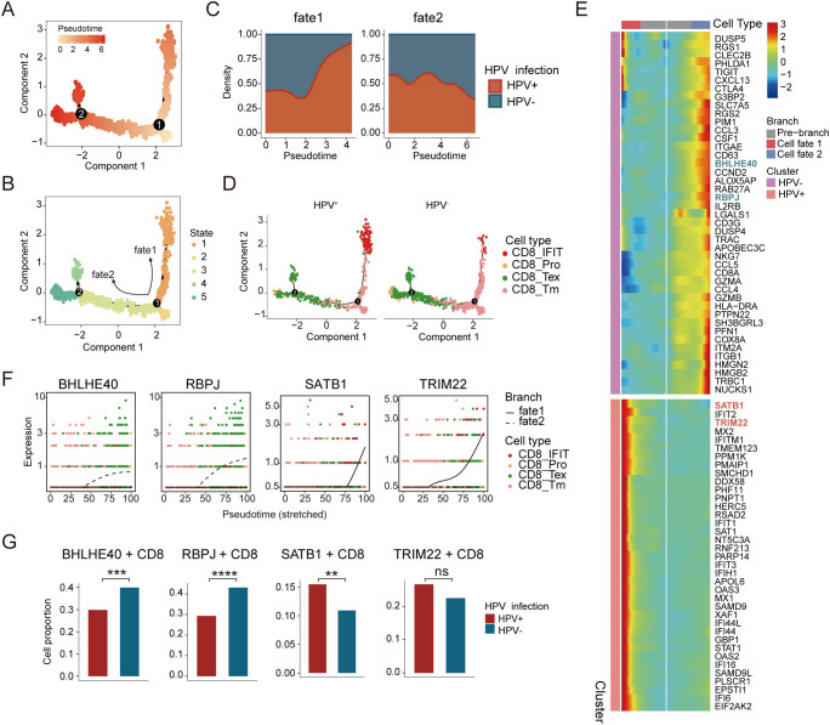
这就解释了:HPV 阴性患者 CD8+T 多但没用,因为大多是耗竭型,这也是其预后差的核心原因之一。
4. 细胞互作分析:搞懂细胞 “怎么说话”(锁定关键调控通路)
用 CellChat 和 CellphoneDB 分析细胞间 ligand-receptor 互作,发现上皮细胞是 “信号发送主力”,且 HPV 正负患者的互作通路完全不同(图 4A-H、图 5A-C):
HPV 阳性患者:上皮细胞通过ANXA1-FPR1/3 通路调控 cDC2 细胞(图 5B),激活的 cDC2 再通过 MHC II 通路作用于 CD4+T 细胞,还通过 LGALS9-CD45 作用于干扰素相关 CD8+T—— 形成 “上皮→cDC2→T 细胞” 的免疫激活链(图 5H);
HPV 阴性患者:上皮细胞通过MDK-LRP1/SORL1 通路调控巨噬细胞 / 单核细胞(图 5C),这些 myeloid 细胞再通过 MHC I 作用于耗竭 CD8+T—— 更关键的是,MDK-LRP1 高表达会降低免疫浸润(图 5E、F),形成 “免疫抑制微环境”;
多色免疫荧光(mIF)验证:HPV + 患者 ANXA1 和 CD4+T 多,HPV - 患者 MDK 和 CD8+T 多(图 5J)。
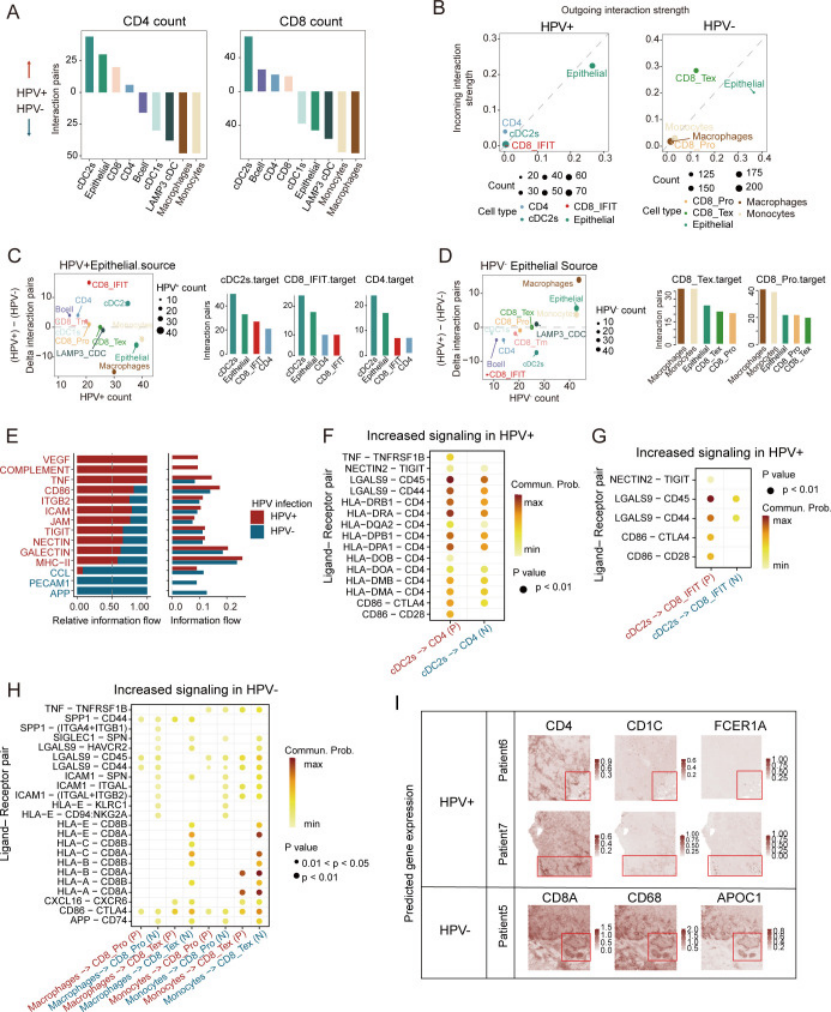
图4
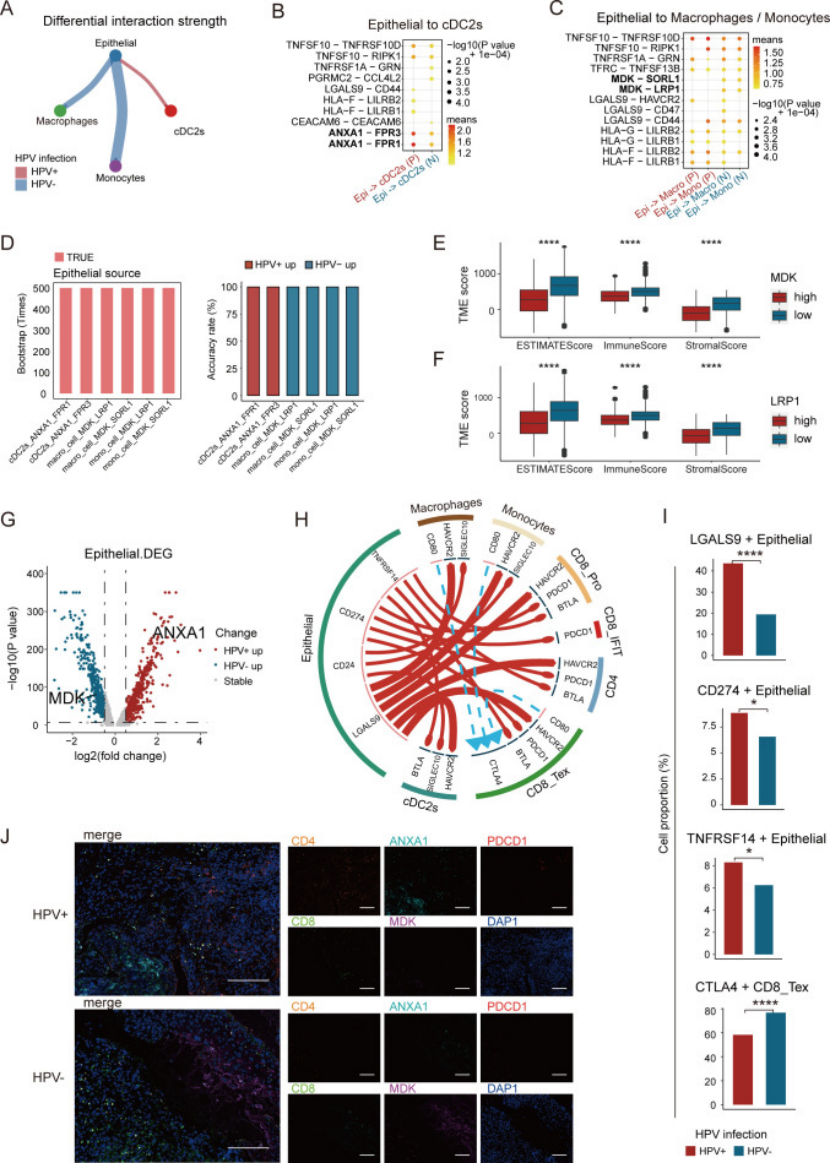
图5
这步是核心机制:医生做细胞互作分析时,别只列通路,要结合 HPV / 分期等临床特征分层,找到 “亚型特异性通路”,比如 ANXA1-FPR1/3(HPV+)、MDK-LRP1(HPV-),这些都是潜在靶点。
5. 上皮细胞预后模型(ERS):落地 “临床能用”(从基础到应用)
既然上皮细胞是“信号发送主力”,研究就用 HPV 阳性患者上皮细胞的差异基因,建了个 12 基因预后模型(ERS):
模型构建:TCGA cohort(269 例 HPV+)中,先单因素 Cox 筛 92 个预后基因,再 LASSO + 多因素 Cox 缩到 12 个基因(图 6A、B);
预后价值:高风险组 OS 显著差于低风险组(图 6C),1/3/5 年 AUC 分别达 0.82/0.80/0.79(图 6D),GSE52903 独立验证有效(图 6H、I);
免疫关联:低风险组免疫浸润更高(CD4+T、CD8+T 多),高风险组 Treg 和 M0 巨噬细胞多(图 6L、M);
治疗预测:在 PRJEB25780 cohort(接受帕博利珠单抗治疗)中,ERS 高风险患者多为 “非响应者”(图 6J)。
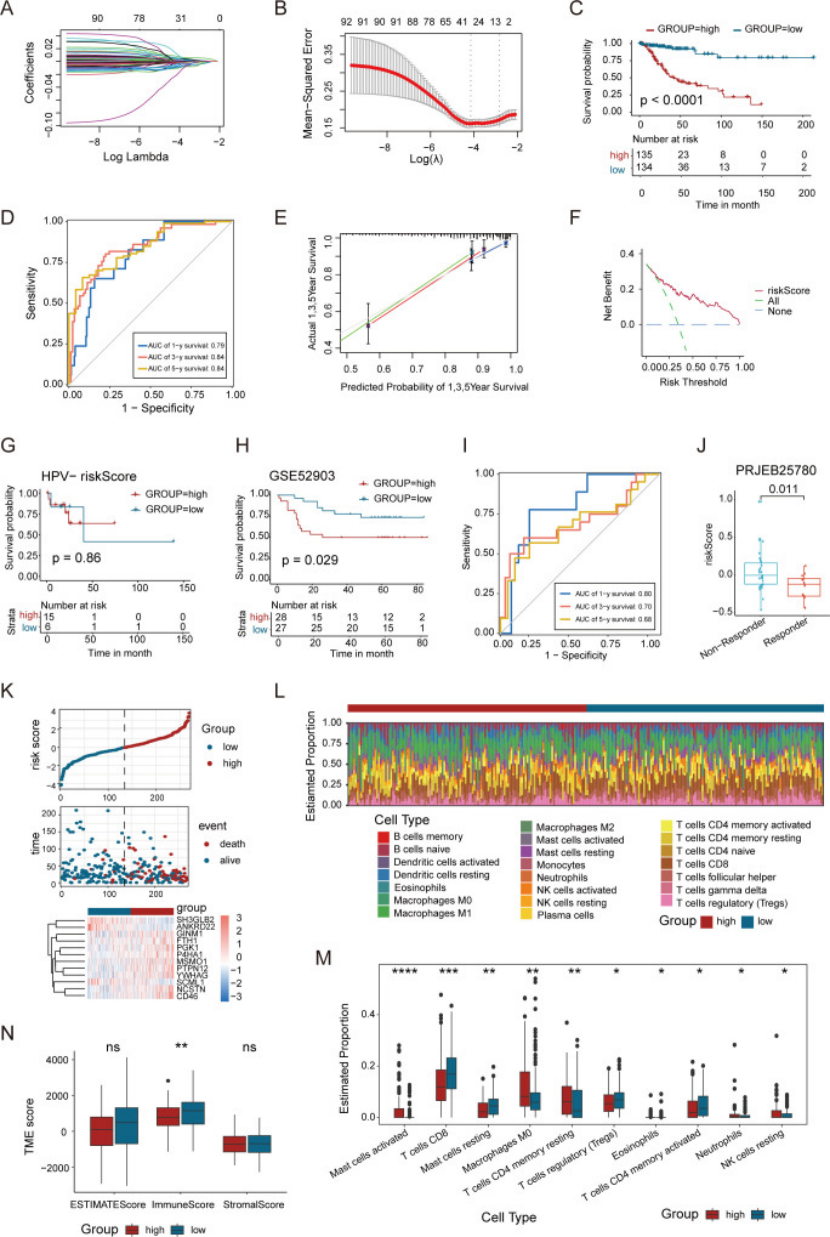
图6
这步太值得学:医生建预后模型,别盲目用“全基因”,聚焦 “上游调控细胞(如上皮细胞)” 的差异基因,模型更有生物学意义,还能关联免疫治疗响应。
从这篇可以提炼出发文的3 个核心思路,首先“分层研究” 是关键:比如按 HPV 状态分层,才能发现 “CD8+T 多但预后差” 这种反常识现象,避免 “平均效应” 掩盖关键差异;
“空间 + 单细胞” 必结合:单细胞看细胞类型和功能,空间看位置和互作,两者结合才能从 “是什么” 到 “为什么”(比如 DC 和 CD4+T 紧邻,才敢说 DC 可能呈递抗原给 CD4+T);
“模型要落地临床”:建预后模型别只看 AUC,还要关联免疫浸润、治疗响应(如 ERS 预测免疫治疗非响应),这样文章才有临床价值,审稿人更认可。
想照着这个框架做宫颈癌多组学研究,不管是缺单细胞 / 空间转录组数据分析、预后模型构建,还是需要多色免疫荧光验证支持,都可以找我们团队!从选题设计到数据挖掘再到结果可视化,全程帮你把控,让你少走弯路,尽快产出符合临床需求的高分成果~
原文DOI:10.3389/fimmu.2025.1612623
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号