
来源:特诺科研
间质性膀胱炎 / 膀胱疼痛综合征(IC/BPS)是泌尿外科 “疑难杂症”,其中 Hunner 型(HIC)症状更严重 —— 患者饱受膀胱剧痛、尿频尿急折磨,晚期甚至需切除膀胱,治疗后复发率高达 40%-50%。长期以来,其发病机制模糊,仅聚焦单一器官研究,缺乏对 “肠 - 膀胱轴” 等系统层面的整合分析,导致诊断无特异标志物、治疗无精准靶点,数百万患者生活质量严重受损。
临床亟待破解:HIC 的上游致病因子是什么?肠道菌群、代谢物与膀胱损伤如何关联?能否找到可干预的关键通路?四川大学华西医院泌尿外科团队牵头,通过多组学整合与层层实验验证,终于揭开这一疾病的核心谜团。

文章信息速览
原标题:Multi-omics analysis identifies a microbiota–bile acid–TLR signaling axis driving bladder injury in interstitial cystitis
期刊:Nature Communications(顶刊,IF=15.7,Open Access,0 版面费)
关键词:Hunner 型间质性膀胱炎(HIC)、多组学、肠道菌群、胆汁酸、TLR3、尿路上皮损伤、粪菌移植(FMT)、靶向代谢组、单细胞 RNA 测序
研究核心亮点
这篇研究的突破在于“多组学联动 + 因果验证”,从 “发现关联” 到 “证实机制” 再到 “干预有效” 形成完整闭环,7 大核心亮点直击关键:
第一步:宏基因组锁定“元凶” 菌群 ——E. avium 在 HIC 患者中显著富集研究首次对 HIC 患者进行粪便宏基因组测序(突破 16S 测序的低分辨率局限),发现 HIC 患者肠道菌群组成与健康人存在显著差异(图 1A、D),其中鸟肠球菌(E. avium)、微小巨球藻等物种富集,且这 3 种核心差异物种的诊断特异性达 88.1%(图 1H)。功能分析显示,这些差异菌群的核心功能集中在胆汁酸代谢(图 1F、G),提示菌群可能通过调控胆汁酸影响膀胱病变。
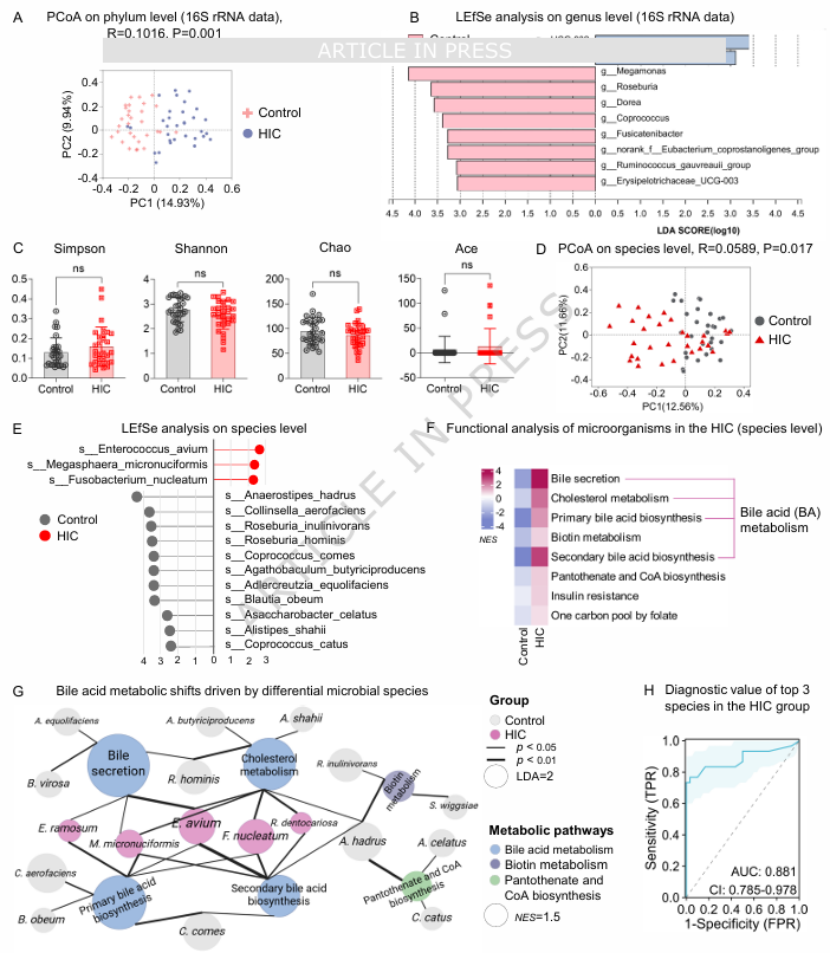
图1
第二步:靶向代谢组发现“毒性介质”——TCDCA 在血 / 尿中双重升高对患者血、尿样本进行靶向代谢组分析,发现胆汁酸代谢是最显著的差异通路(图 2E、F),其中牛磺鹅脱氧胆酸(TCDCA)在 HIC 患者的血液和尿液中均显著上调(图 2G、H),而另一种胆汁酸 TUDCA 则呈保护性作用(与屏障功能正相关)。这一发现首次将胆汁酸代谢异常与 HIC 关联,为 “菌群 - 代谢物” 联动提供直接证据。
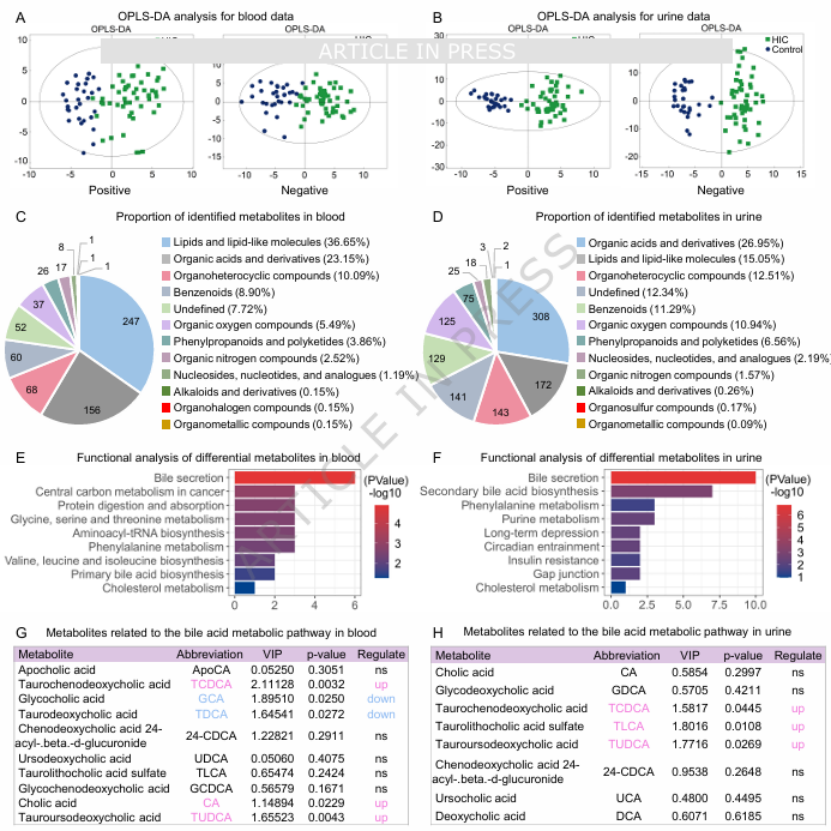
图2
第三步:单细胞测序锁定“作用靶点”——TLR3 在尿路上皮细胞异常激活通过单细胞 RNA 测序解析 HIC 患者膀胱组织,发现尿路上皮细胞(UCs)是损伤核心细胞:上调基因富集于炎症反应、TLR 信号通路,下调基因集中于紧密连接(屏障功能相关)(图 3E-H)。进一步分析显示,TLR3 是尿路上皮细胞中上调最显著的 TLR 亚型(图 3K),且在患者膀胱组织中通过 mRNA 和蛋白水平双重验证(图 3L-N),提示 TLR3 是介导损伤的关键分子。

图3
第四步:关联网络证实“三角关系”——E. avium-TCDCA-TLR3 形成致病轴通过 Spearman 相关性分析构建多组学关联网络,证实:E. avium 丰度与血 / 尿 TCDCA 水平正相关(图 4A、B);TCDCA 与 TLR3 表达正相关,与紧密连接蛋白(如 ZO-1)表达负相关(图 4C、D);且 E. avium 丰度和 TCDCA 水平均与患者症状评分(尿频、疼痛)正相关(图 4G),直接证实三者构成 “菌群 - 代谢物 - 受体” 的致病通路。

图4
第五步:粪菌移植(FMT)验证 ——HIC 菌群可传递疾病表型将 HIC 患者或健康人的粪便菌群移植给抗生素预处理小鼠,结果显示:接受 HIC 菌群移植的小鼠,无论是否为自身免疫性膀胱炎模型,均出现尿频增多、疼痛阈值降低(图 5C、D),膀胱组织呈现尿路上皮变薄、屏障损伤(ZO-1 表达降低)、炎症激活(TNF-α 升高)和 TLR3 上调(图 5E),且尿液中 TCDCA 水平同步升高(图 5F)。这直接证实 HIC 患者的肠道菌群可通过调控胆汁酸代谢,诱导膀胱损伤(图 5)。
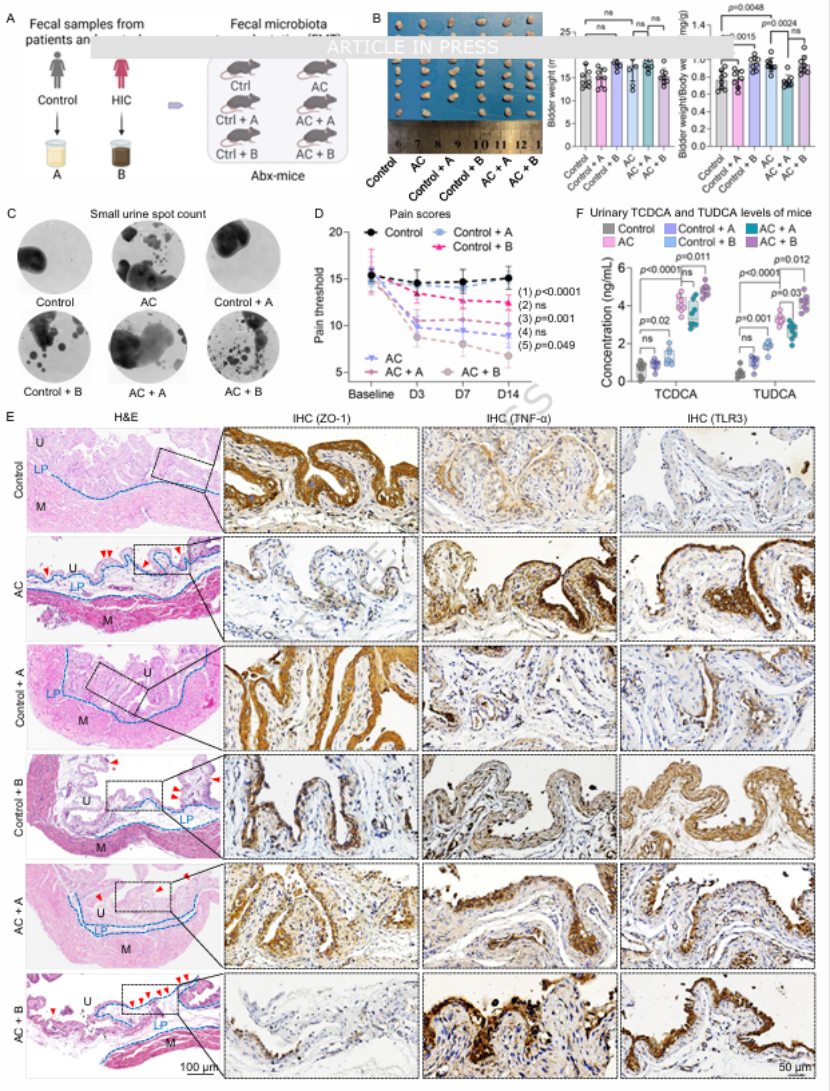
图5
第六步:细菌移植 + 代谢物输注 ——E. avium 通过 TCDCA 直接致病为明确 E. avium 的直接作用,将其单独移植给小鼠,结果显示小鼠出现典型 HIC 样表型(尿频、疼痛、膀胱损伤),且血 / 尿 TCDCA 水平显著升高(图 6B-G)。体外实验证实,200μM TCDCA 可直接抑制尿路上皮细胞活力、破坏紧密连接、激活 TLR3 和 TNF-α 表达(图 6H、I);体内膀胱内输注 TCDCA 也可成功诱导大鼠膀胱损伤(图 6J-M),彻底证实 E. avium 通过上调 TCDCA 致病的因果关系。
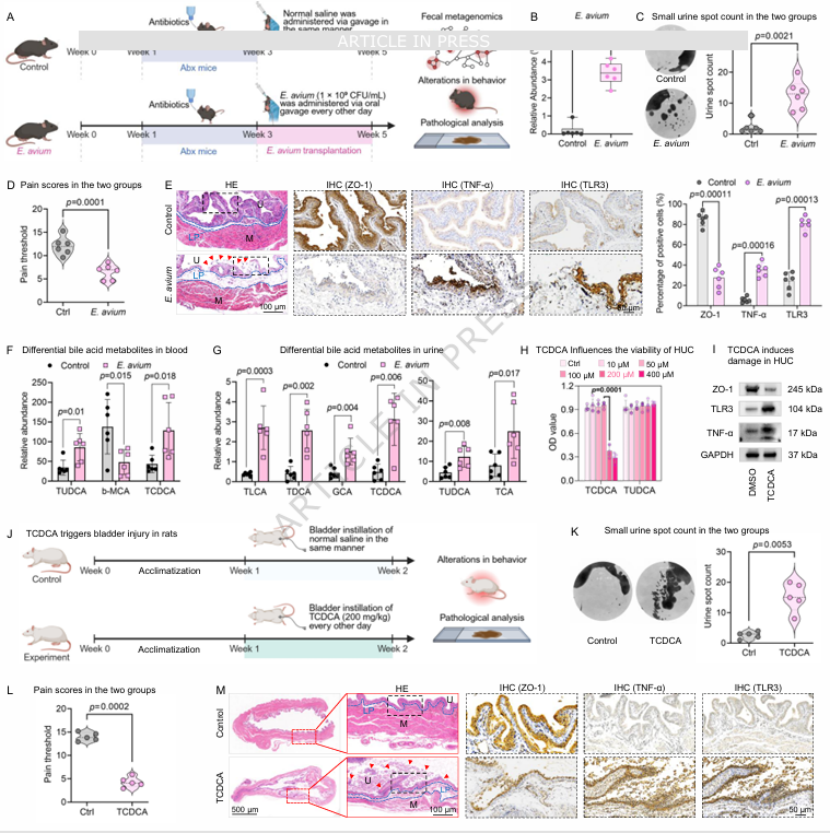
图6
第七步:干预实验证实“有效逆转”——TLR3 抑制 + PPS 可改善损伤针对核心通路设计干预实验:体外培养尿路上皮细胞,TLR3 抑制剂(siRNA 或 CU-CPT 4a)可逆转 TCDCA 诱导的屏障破坏和炎症(图 7A-C);FDA 批准药物 PPS(戊聚糖硫酸钠)也可上调 ZO-1、下调 TLR3 和 TNF-α,恢复细胞屏障功能(图 7D-F)。体内实验中,TLR3 抑制剂或 PPS 治疗可显著改善 TCDCA 诱导的大鼠尿频、疼痛和膀胱病理损伤(图 7H、I),为临床转化提供直接依据。
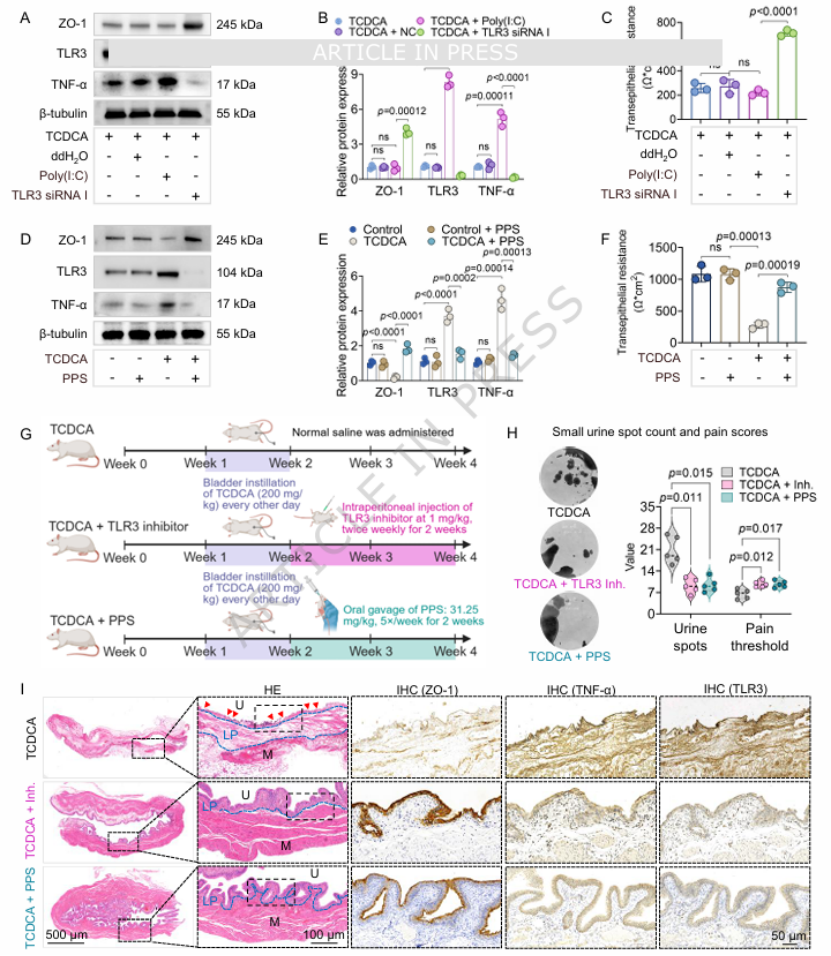
图7
临床价值
对患者:提供首个“菌群 + 代谢物” 联合诊断标志物(E. avium+TCDCA),诊断特异性达 88.1%,解决 HIC 诊断无特异指标的困境;
对临床:揭示 TLR3 为全新治疗靶点,TLR3 抑制剂和 PPS 可直接干预致病通路,为 HIC 提供精准治疗方案(替代传统对症治疗);
对科研:首次阐明“肠 - 膀胱轴” 在 HIC 中的作用机制,证实菌群通过代谢物调控远端器官损伤,为跨器官疾病研究提供范式;
对转化:粪菌移植可调节肠道菌群,为顽固性 HIC 患者提供全新治疗思路,且 PPS 已获批临床使用,大大缩短转化周期。
结语
这篇发表于 Nature Communications(IF=15.7,Open Access,0 版面费)的研究,由四川大学华西医院团队牵头,通过 “宏基因组 + 靶向代谢组 + 单细胞 RNA 测序” 的多组学整合策略,首次揭示 “E. avium-TCDCA-TLR3” 轴是 HIC 尿路上皮损伤的核心致病机制。
研究不仅打破了“间质性膀胱炎仅为膀胱局部疾病” 的认知,更通过粪菌移植、细菌定植、代谢物输注等层层验证,证实了该通路的因果关系,最终提供了可直接转化的治疗方案(TLR3 抑制剂 + PPS)。对于饱受尿频、膀胱疼痛折磨的 HIC 患者而言,这一发现意味着未来可能通过 “检测菌群 / 代谢物” 实现精准诊断,通过 “靶向 TLR3” 或 “调节肠道菌群” 实现精准治疗,彻底摆脱 “难治、易复发” 的困境。
未来,随着前瞻性临床研究的推进,这一“菌群 - 代谢物 - 受体” 的干预模式有望成为 HIC 治疗的新标准,也为其他 “肠 - 器官轴” 相关疾病(如肠 - 肾、肠 - 肝疾病)的研究提供重要参考。
原文DOI: 10.1038/s41467-025-68060-1
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号