
来源:特诺科研
胃癌(GC)尤其是腹膜转移亚型,因间质纤维化导致治疗耐药、预后极差,中位生存期仅 7-15 个月,5 年生存率不足 2%。上海交通大学医学院附属瑞金医院团队聚焦这一临床痛点,整合空间转录组、单细胞测序、bulk RNA-seq 与深度学习技术,构建多维度研究体系,首次发现 “巨噬细胞 - 成纤维细胞 - 肿瘤细胞(MFM)” 共浸润模式,解析其核心调控机制,并开发出基于 HE 染色切片的预后预测模型 Gastric-Discovery,相关成果以开放获取形式(0 版面费)发表于《npj Digital Medicine》(IF=15.1),为胃癌精准诊疗与多组学研究提供了可直接借鉴的范本。

图1 文献信息
文献信息速览
原标题:Multi-dimensional omics integrated machine learning framework identifies macrophage-fibroblast-tumor co-infiltration patterns to predict prognosis in gastric cancer
期刊:npj Digital Medicine(IF=15.1,Q1 顶刊,开放获取0 版面费)
关键词:胃癌、腹膜转移、多组学、空间转录组、单细胞测序、MFM 共浸润模式、PLAU-PLAUR 轴、深度学习
核心成果:
这篇论文的核心价值的在于“从临床问题出发,用技术组合解决问题,以临床转化收尾”,全程逻辑闭环,每个结论都有多层数据支撑,尤其值得医生学习的是,团队将空间异质性、细胞互作、机制验证与 AI 转化完美串联,让研究既有深度又有实用价值。
核心发现一:空间转录组锁定“致命微环境”——MFM 共浸润模式团队通过 ESTIMATE 算法分析发现,胃癌及腹膜转移组织的间质评分显著高于正常组织,且高间质评分患者预后更差(图 2A-C、F)。进一步对 8 例胃癌空间转录组数据进行分析,鉴定出 8 个不同生态位(Niche),其中 Niche_4(巨噬细胞 + 成纤维细胞富集)与 Niche_1(肿瘤细胞主导)呈现强烈的空间邻域富集信号(图 2H-J),形成 “巨噬细胞 - 成纤维细胞包裹肿瘤细胞” 的 armor-like 结构,命名为 MFM 共浸润模式(图 3B-D)。多重免疫荧光验证证实,CD68⁺巨噬细胞与 α-SMA⁺成纤维细胞围绕肿瘤细胞聚集,且排斥 CD8⁺T 细胞浸润(图 3E-F),直接解释了该模式的免疫抑制特性。
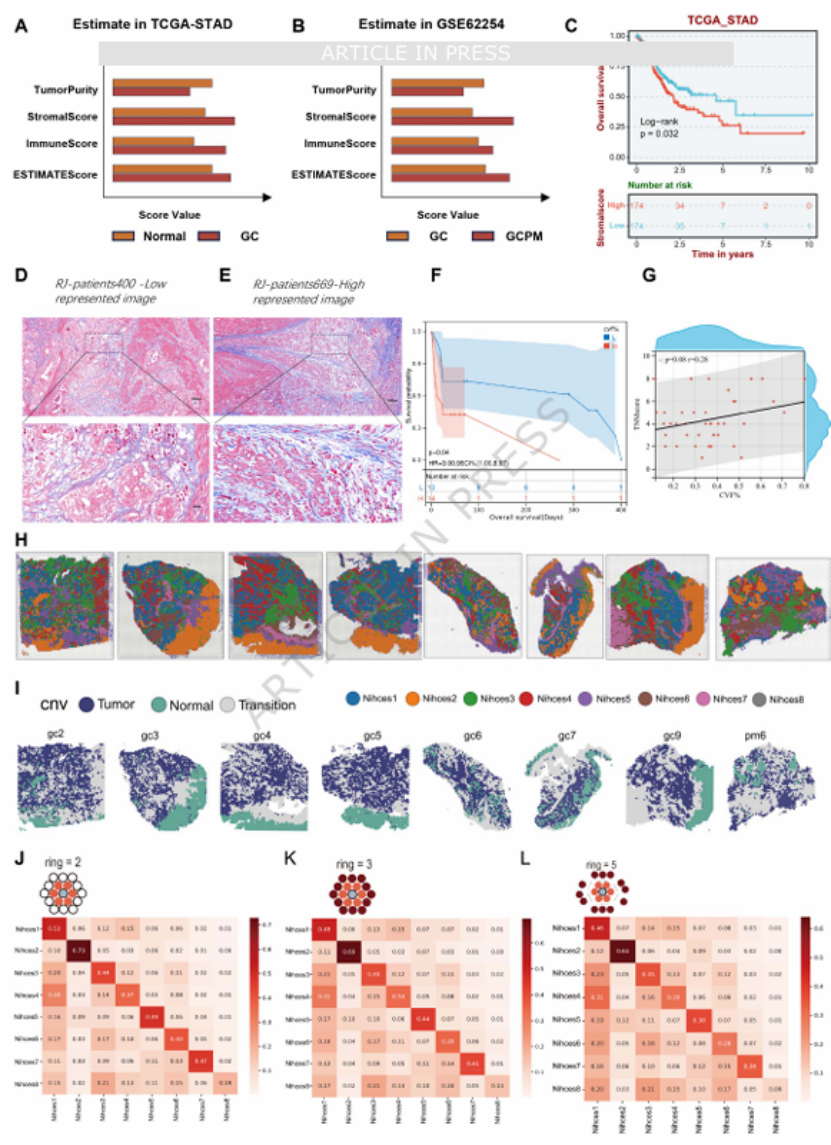
图2
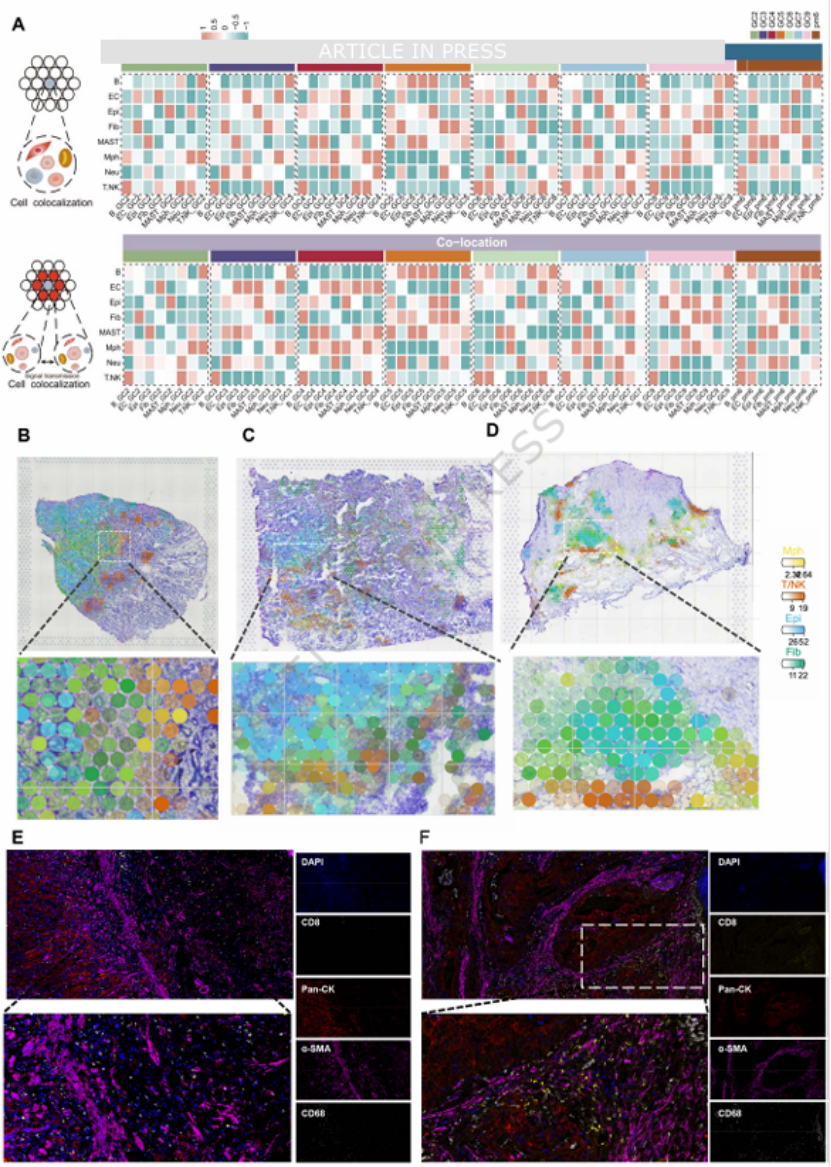
图3
核心发现二:单细胞测序解析核心“参与者”——ACTA2⁺myCAFs 与 DAB2⁺TAMs为明确 MFM 模式的核心细胞亚群,团队整合 41 例样本(正常胃组织、原发胃癌、腹膜转移灶)的单细胞数据,鉴定出 6 种成纤维细胞亚型与 6 种巨噬细胞亚型(图 4D、5A):
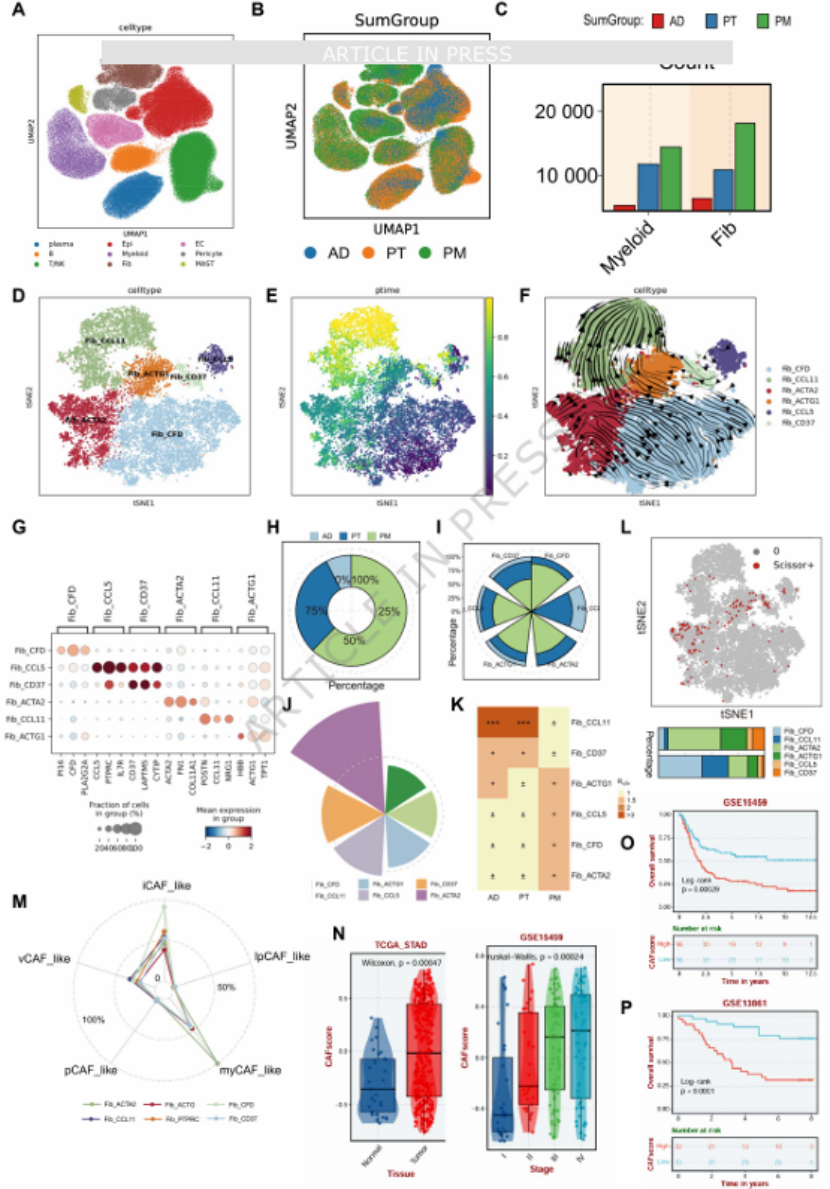
图4
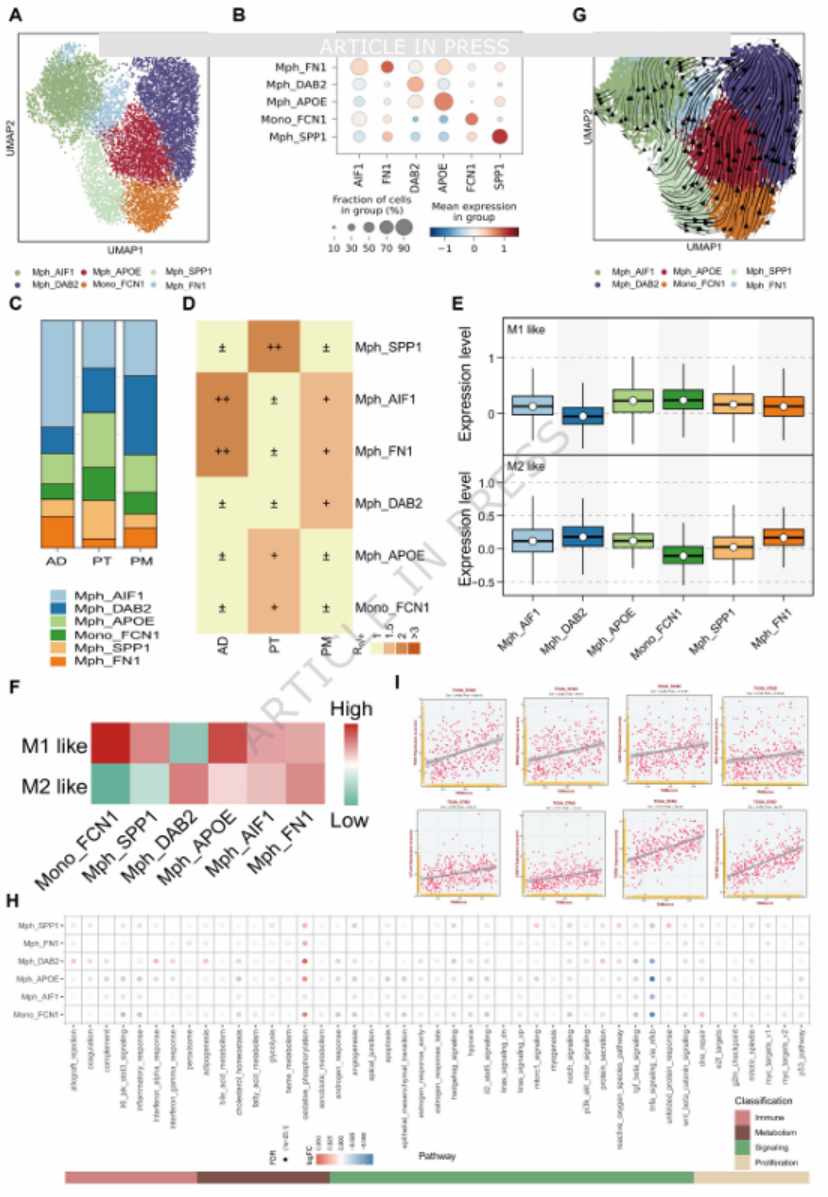
图5
成纤维细胞中,ACTA2⁺肌成纤维细胞(myCAFs)在腹膜转移灶中富集,且与远处转移高度相关(Scissor + 细胞占比最高),高浸润患者预后极差(图 4L、N-P),是 MFM 模式的核心成纤维细胞亚群;
巨噬细胞中,DAB2⁺肿瘤相关巨噬细胞(TAMs)呈 M2 极化表型,在原发灶与转移灶中持续富集,且其特征评分与 PDCD1、CD274(PD-L1)等免疫检查点分子正相关(图 5C-E、I),是免疫抑制的关键执行者。CellTrek 空间共定位分析进一步证实,ACTA2⁺myCAFs 与 DAB2⁺TAMs 在原发灶与转移灶中均存在稳定的空间共定位(图 6C-G),二者共同构成 MFM 模式的 “核心单元”。
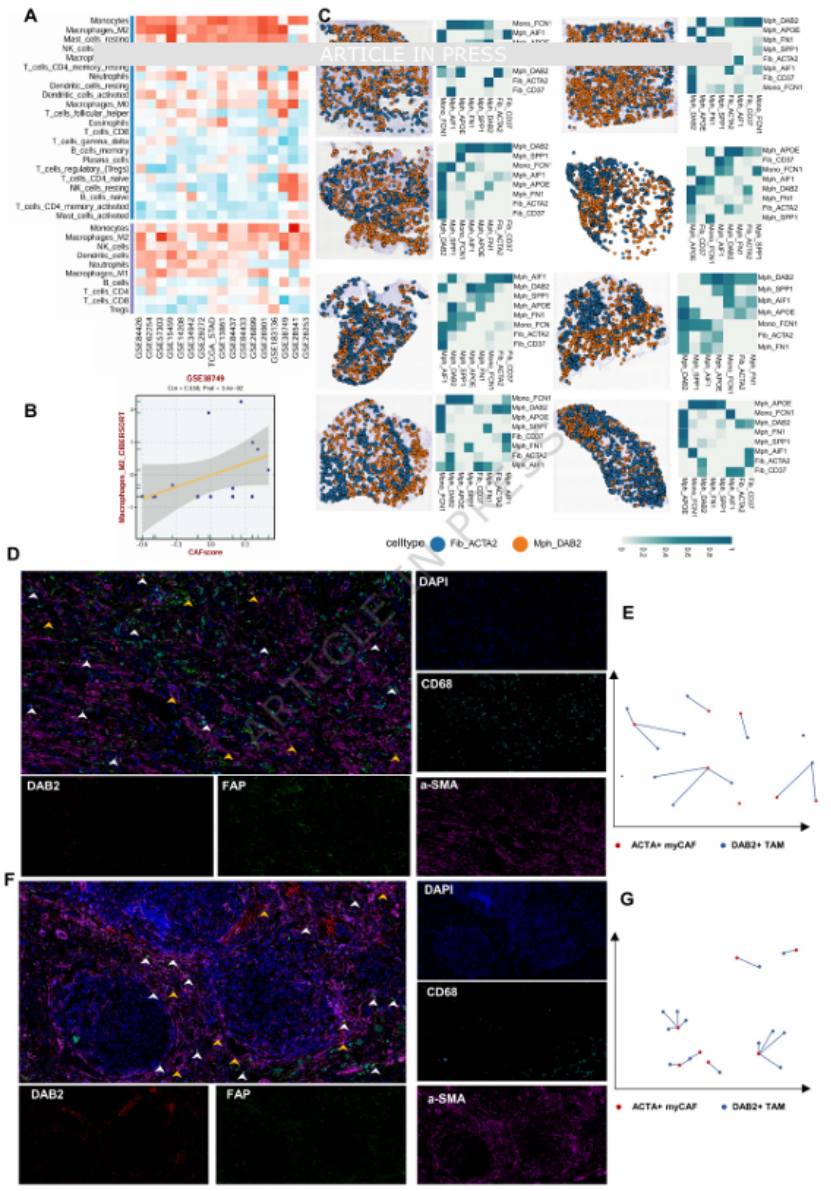
图6
核心发现三:机制突破——PLAU-PLAUR 轴驱动 MFM 模式形成通过 NicheNet 与 COMMOT 分析,团队鉴定出巨噬细胞、成纤维细胞与肿瘤细胞间的关键通讯轴 ——PLAU-PLAUR 信号通路(图 7B-E)。体外实验证实,外源性重组 PLAU(rh-PLAU)可剂量依赖性促进胃癌细胞增殖、集落形成与迁移(图 7F-I),表明该通路通过调控上皮间质转化(EMT),推动 MFM 模式的形成与肿瘤进展,为靶向治疗提供了明确靶点。
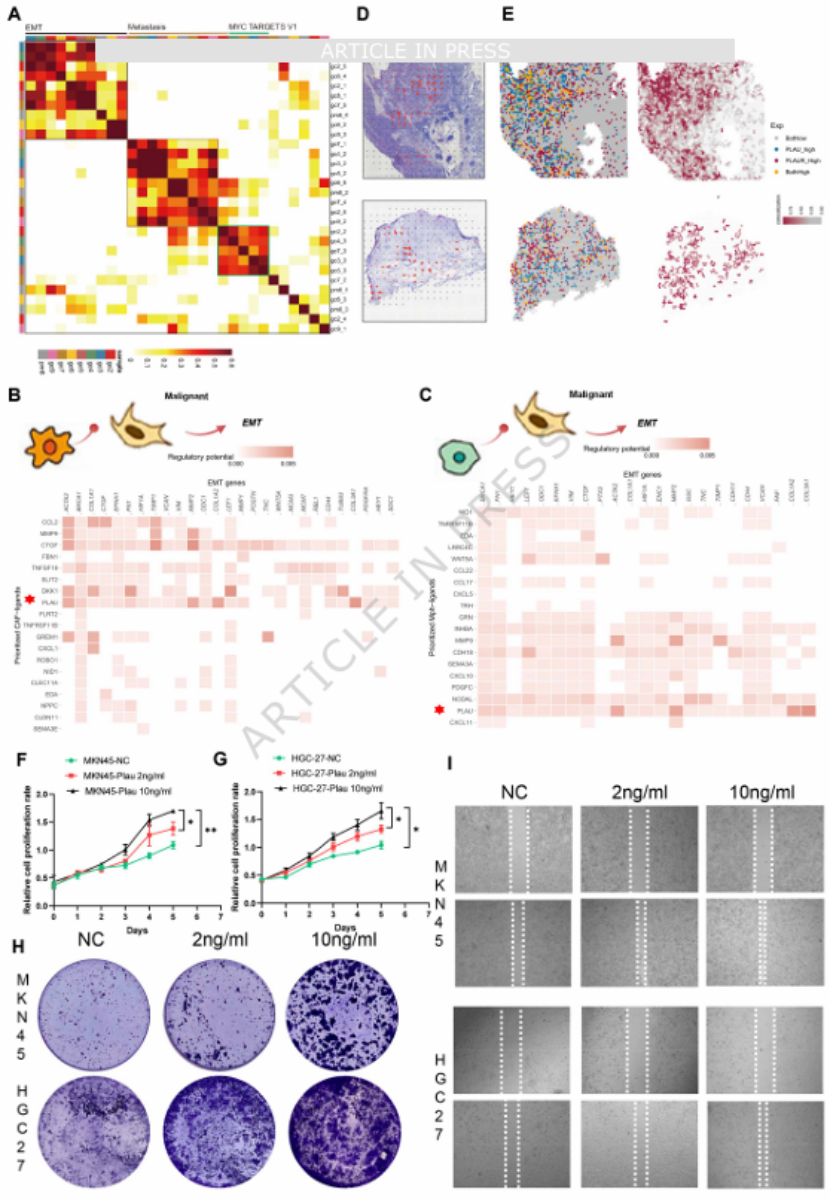
图7
核心发现四:AI 转化 ——Gastric-Discovery 模型实现 “HE 切片预测预后”考虑到临床中 IHC 染色的主观性与复杂性,团队基于 ResNet-50 模型进行迁移学习,以 TCGA-STAD 队列的 HE 染色切片为训练集,开发出可识别 MFM 模式的深度学习框架 Gastric-Discovery(图 8C)。该模型在验证集中表现优异(精准度 = 0.961,特异性 = 0.949,召回率 = 0.864)(图 8F-G),且能准确区分高 / 低 MFM 模式患者的预后风险(图 8H-I),甚至可与空间转录组鉴定的 MFM 区域精准匹配(图 8J-K),实现了从基础研究到临床实用工具的直接转化。
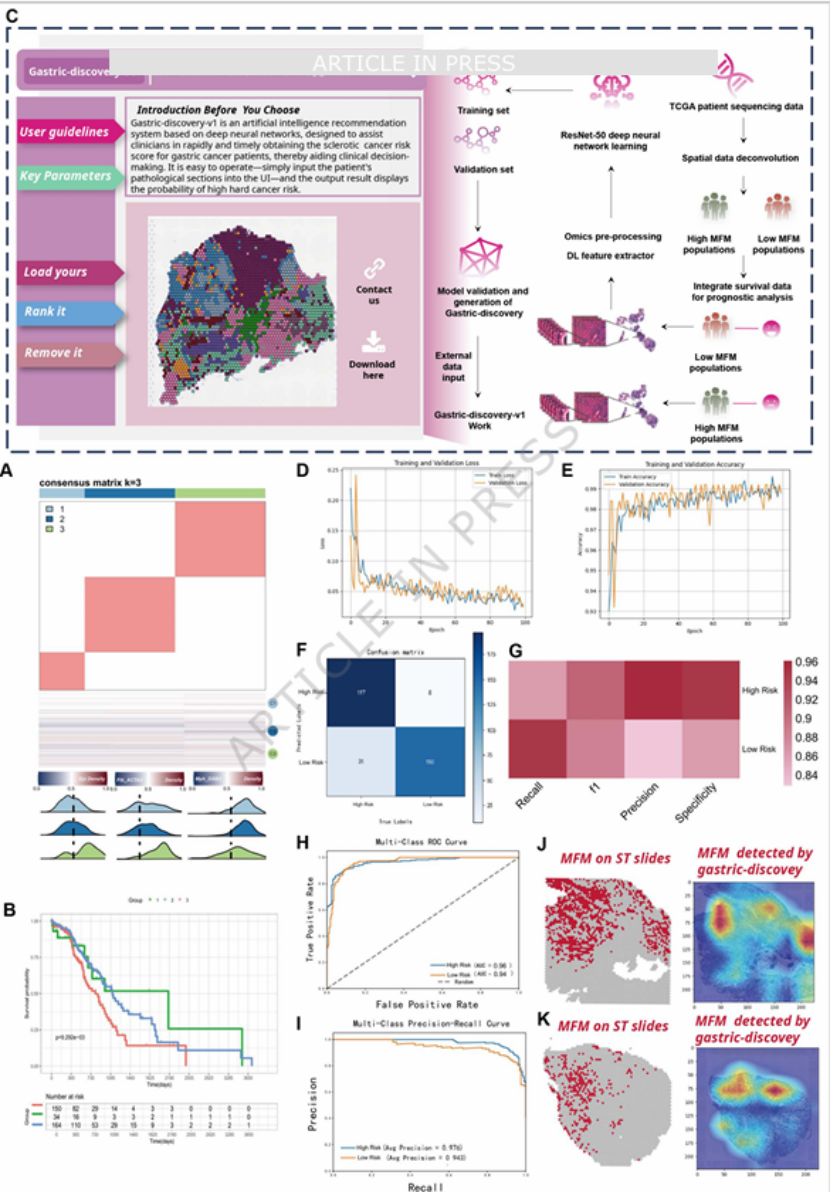
图8
很多医生觉得多组学“技术复杂、数据难整合”,但这篇论文证明:只要找对临床痛点、选对技术组合,高分 SCI 并不难。结合研究细节与图件,拆解4 个关键发文步骤:
第一步:锚定临床痛点——从 “治疗瓶颈” 切入,让研究有价值
多组学不是“技术堆砌”,核心是解决临床问题。团队开篇就聚焦 “胃癌腹膜转移间质纤维化导致治疗耐药” 这一临床瓶颈,通过 ESTIMATE 评分与 Masson 染色(图 2D-E)证实间质活化与预后的关联,为后续研究奠定 “临床意义” 基础。✔️ 医生发文启示:从自己熟悉的临床场景入手(如化疗耐药、转移复发、预后不佳的亚型),用简单的评分或染色验证问题的严重性,再引入多组学技术深入探究,既贴合临床又降低创新门槛。
第二步:空间 + 单细胞,破解 “空间异质性” 难题
传统单细胞测序缺失空间信息,而空间转录组难以解析细胞亚型,团队将二者结合,完美解决了“细胞在哪、谁在互作” 的核心问题:
用空间转录组找到 MFM 共浸润的空间模式(图 2H-J、3B-D);
用单细胞测序鉴定模式中的核心细胞亚群(ACTA2⁺myCAFs、DAB2⁺TAMs)(图 4D、5A);
用 CellTrek 与多重免疫荧光验证二者的空间共定位(图 6C-G)。✔️ 医生发文启示:针对实体瘤研究,“空间转录组 + 单细胞测序” 是当前顶刊青睐的黄金组合,可快速锁定 “空间模式 - 核心细胞” 的关联,避免单一技术的局限性。
第三步:机制深挖——细胞互作 + 体外实验,让结论落地
找到模式与细胞后,需明确“如何互作、驱动肿瘤进展”。团队通过 NicheNet 分析筛选出 PLAU-PLAUR 信号轴(图 7B-E),再用 CCK-8、集落形成、划痕实验(图 7F-I)验证其功能,形成 “空间模式→细胞亚群→信号通路→功能验证” 的完整机制链。✔️ 医生发文启示:机制研究无需复杂,聚焦 “细胞 - 细胞通讯”(如配体 - 受体轴),结合简单的体外实验(增殖、迁移、分化)即可,关键是紧扣前面发现的核心模式,避免 “机制与表型脱节”。
第四步:临床转化——AI 模型让研究“能用”,提升顶刊竞争力
顶刊高度重视研究的临床实用性,团队开发的 Gastric-Discovery 模型,将基础研究发现转化为可直接用于临床的预后工具,仅需常规HE 切片即可预测 MFM 模式与患者预后(图8C-K),大幅提升了研究的转化价值。
医生发文启示:结合 AI / 深度学习,将多组学发现转化为简单易用的临床工具(如预后预测模型、病理切片识别工具),是当前高分刊的重要加分项,且技术可复用(如 ResNet-50 迁移学习),无需从零搭建模型。
临床转化亮点:从靶点到工具,让研究有“落地可能”
靶向治疗:PLAU-PLAUR 轴抑制剂可与 NIPS 疗法(腹腔温热化疗)联合,破解腹膜转移灶的间质屏障,提升药物渗透效率;
预后评估:Gastric-Discovery 模型可直接应用于临床,通过常规 HE 切片快速区分高风险患者,指导个体化治疗;
联合免疫治疗:MFM 模式导致免疫排斥,靶向 ACTA2⁺myCAFs 或 DAB2⁺TAMs 可能逆转免疫抑制,与 PD-1/PD-L1 抑制剂联合提升响应率。
这篇论文从临床痛点出发,用“空间 + 单细胞 + AI” 的技术组合构建了完整的研究体系,每个环节都有数据支撑(且明确引用图号),既符合顶刊的学术要求,又为医生提供了可直接借鉴的多组学研究框架。对于想冲击高分刊的医生而言,关键不在于 “用最前沿的技术”,而在于 “用对技术解决临床问题”,这正是上海交大医学院瑞金医院团队给我们的核心启示。
原文DOI:10.1038/s41746-025-02179-9
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号