
来源:特诺科研
乳腺癌放疗抵抗是临床 Oncology 的“老大难”——HER2 + 亚型抵抗率高,患者复发风险陡增,而核心驱动细胞和分子靶点一直模糊不清。近日,浙江大学第二附属医院、同济大学团队联合在《Theranostics》(顶刊,IF=13.3,0 版面费)发表重磅成果:通过“bulk RNA-seq + 单细胞 + 空间转录组 + 多组学+ 实验验证” 的完整闭环,首次锁定 “高放疗抵抗上皮细胞(RRhighepi)”,挖出核心靶点P4HA2,还构建了能精准分层预后的SSRR 模型,为放疗增敏提供全新方向!

图1 文献信息
文章信息速览
原标题:Single-cell and spatial transcriptomics reveal P4HA2-mediated radiotherapy resistance mechanisms in breast cancer
期刊:Theranostics(IF=13.3)
关键词:乳腺癌、放疗抵抗、单细胞测序、空间转录组、P4HA2、机器学习、多组学、预后模型
研究背景与临床痛点
乳腺癌放疗抵抗是临床治疗的“拦路虎”:
亚型差异显著:HER2 + 乳腺癌放疗抵抗最强,而 TNBC 虽获益明显,但仍有部分患者耐药复发(SEER 数据库 37 万 + 患者数据证实,放疗后 13% 出现二次 malignancies);
机制模糊不清:现有研究只知道细胞周期、代谢重编程可能相关,但具体是哪些细胞在“搞事”、核心靶点是什么,一直没有明确答案。
研究核心目标
① 筛选乳腺癌放疗抵抗的核心细胞群和分子靶点;② 阐明靶点介导放疗抵抗的分子机制(细胞周期、代谢、肿瘤微环境层面);③ 构建临床可用的预后模型,指导个性化治疗;④ 为放疗增敏提供潜在干预靶点,填补临床空白。
研究核心亮点:
这篇顶刊的精髓在于“从临床问题出发,用多组学层层拆解,最后实验验证”,5 个核心步骤完美契合医生发文逻辑,每个步骤都有明确数据和图号支撑:
第一步:Bulk RNA-seq 打底,锁定放疗抵抗基因 panel(图 2)
研究先从 TCGA-BRCA 和 GSE120798 两个队列入手,通过差异分析筛选出放疗抵抗相关基因 panel,核心发现:
该基因 panel 在肿瘤组织中显著上调,且富集于细胞周期通路(如 G2/M checkpoint,图 2D);
组织特异性强:在乳腺组织中表达最高(图 2E),细胞层面主要集中在乳腺上皮细胞、内皮细胞(图 2F);
细胞系验证:MCF7、MDAB-231 等放疗抵抗细胞系中,该 panel 的 ssGSEA 评分显著高于敏感株(图 2G-I)。
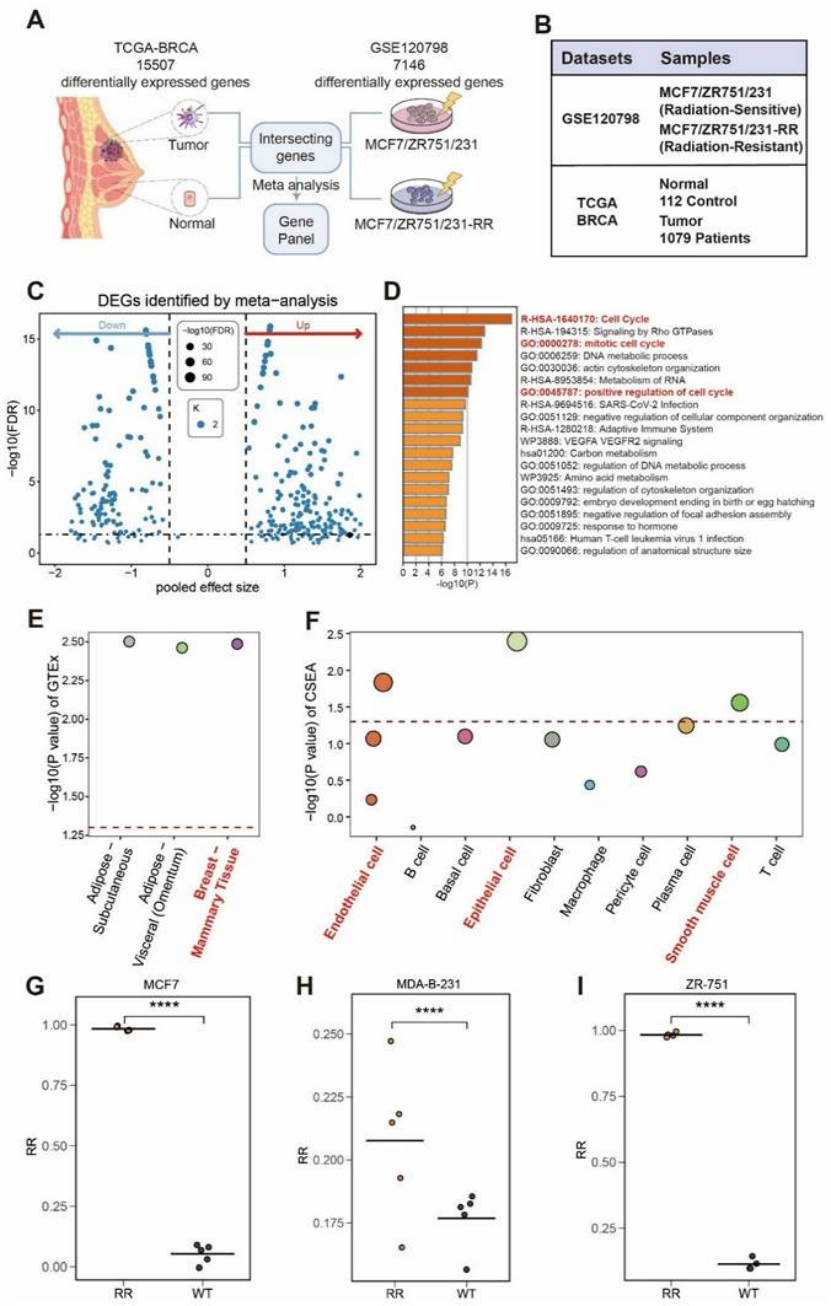
图2
医生发文启示:先从公共队列找差异基因 / 面板,为后续研究打基础,是多组学论文的 “入门必备步骤”。
第二步:单细胞 + 空间转录组,精准定位抵抗 “元凶”——RRhighepi 细胞群(图 3-6)
用单细胞和空间转录组进一步锁定抵抗细胞的“真面目”:
细胞特异性:单细胞测序(GSE176078、GSE161529)证实,抵抗基因 panel 在乳腺癌上皮细胞中评分最高,且肿瘤组织上皮细胞的评分显著高于正常组织(图 3A-F);
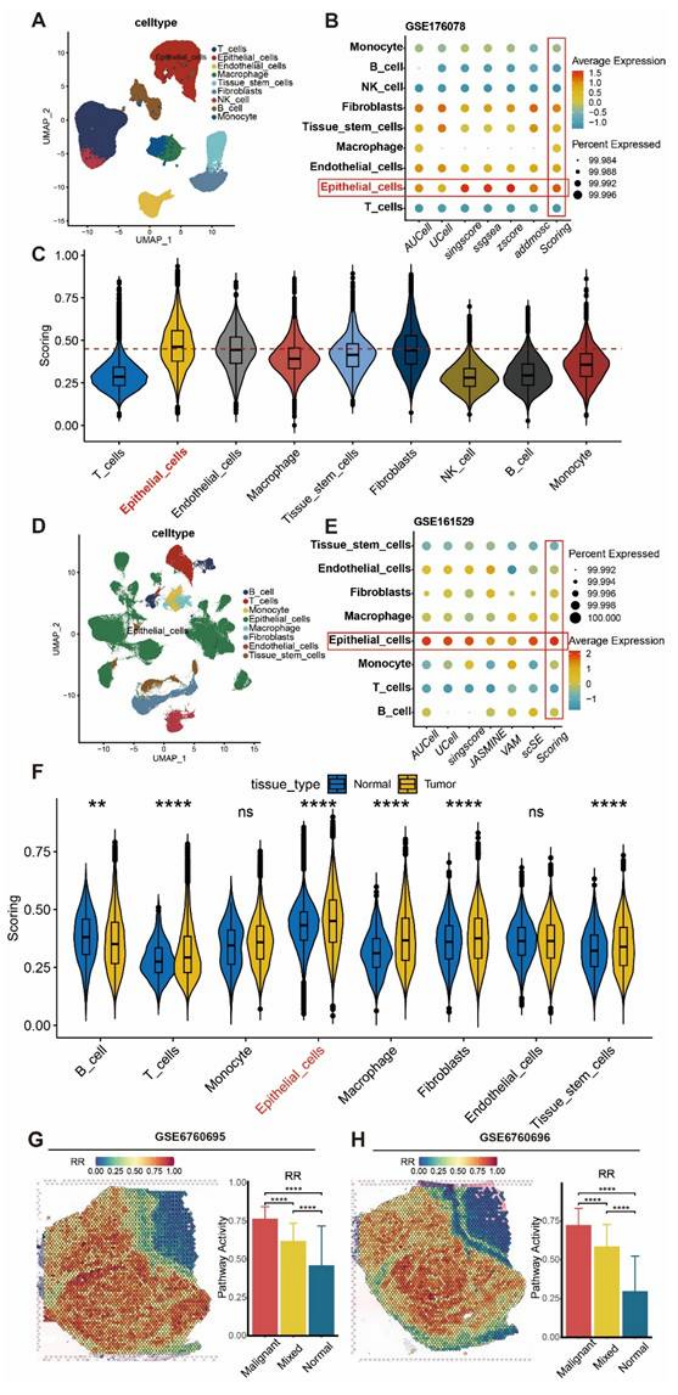
图3
定义 RRhighepi 细胞群:将上皮细胞按评分分为高抵抗(RRhighepi)和低抵抗(RRlowepi),前者富集细胞周期、DNA 损伤修复通路,干性特征显著(图 4B-C);
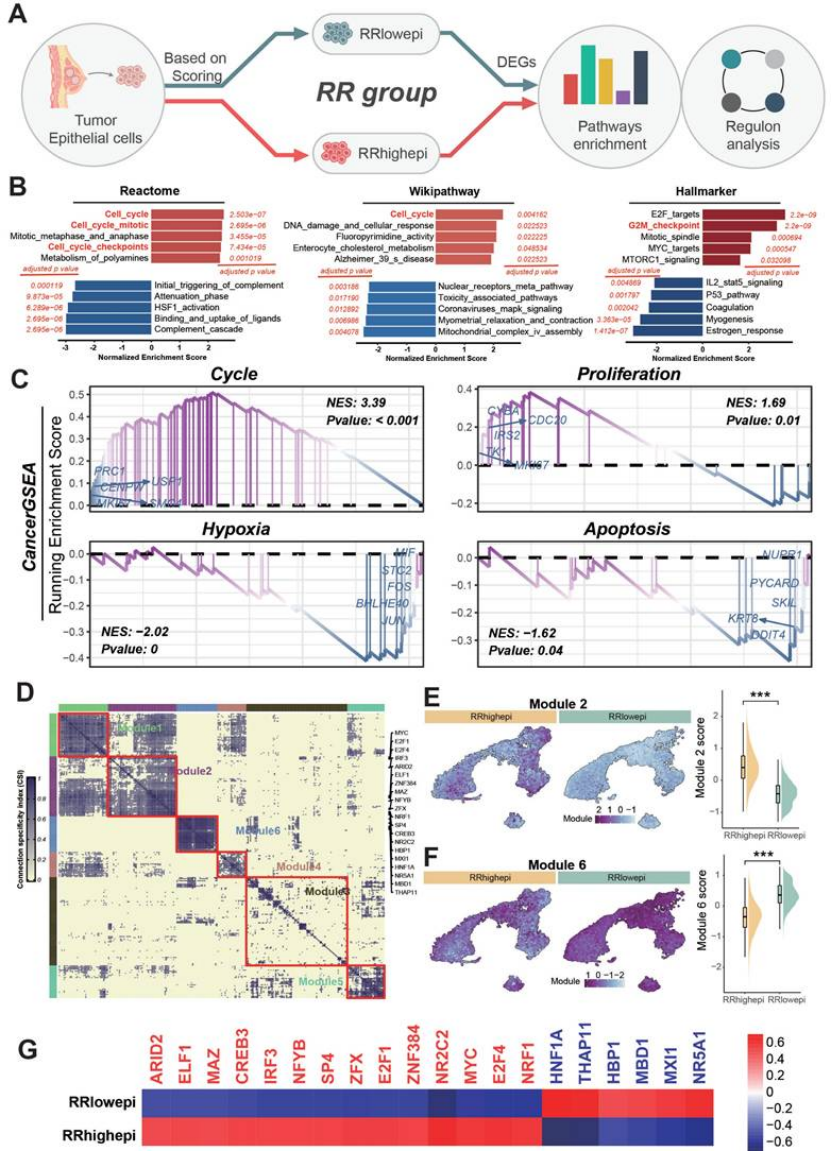
图4
空间定位:空间转录组(GSM6760695-697)显示,RRhighepi 主要集中在肿瘤恶性区域,且与内皮细胞相邻(图 3G-H);
发育轨迹:伪时间分析(monocle2)和空间轨迹分析(stlearn)证实,RRhighepi 是 “发育起点”,会分化为 RRlowepi,且抵抗特征随分化逐渐减弱(图 5D-E、6D-I)。
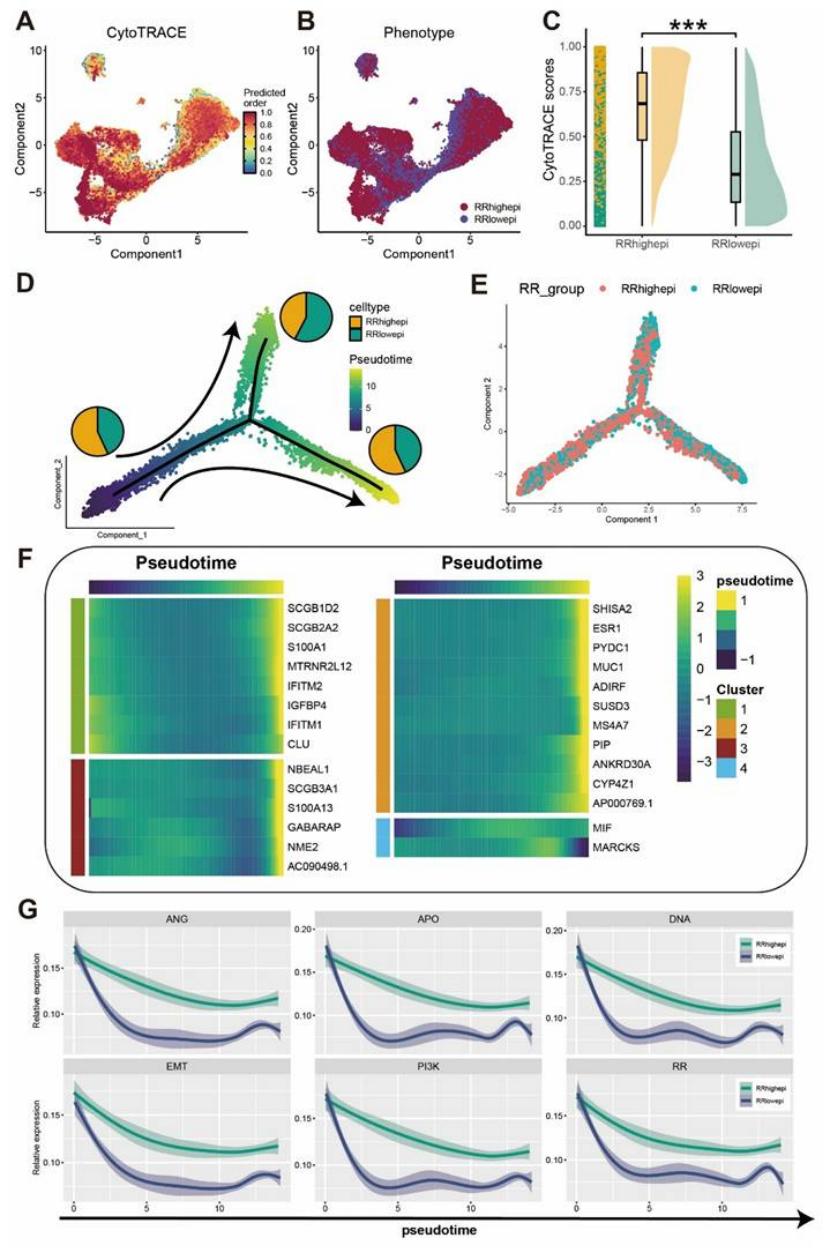
图5
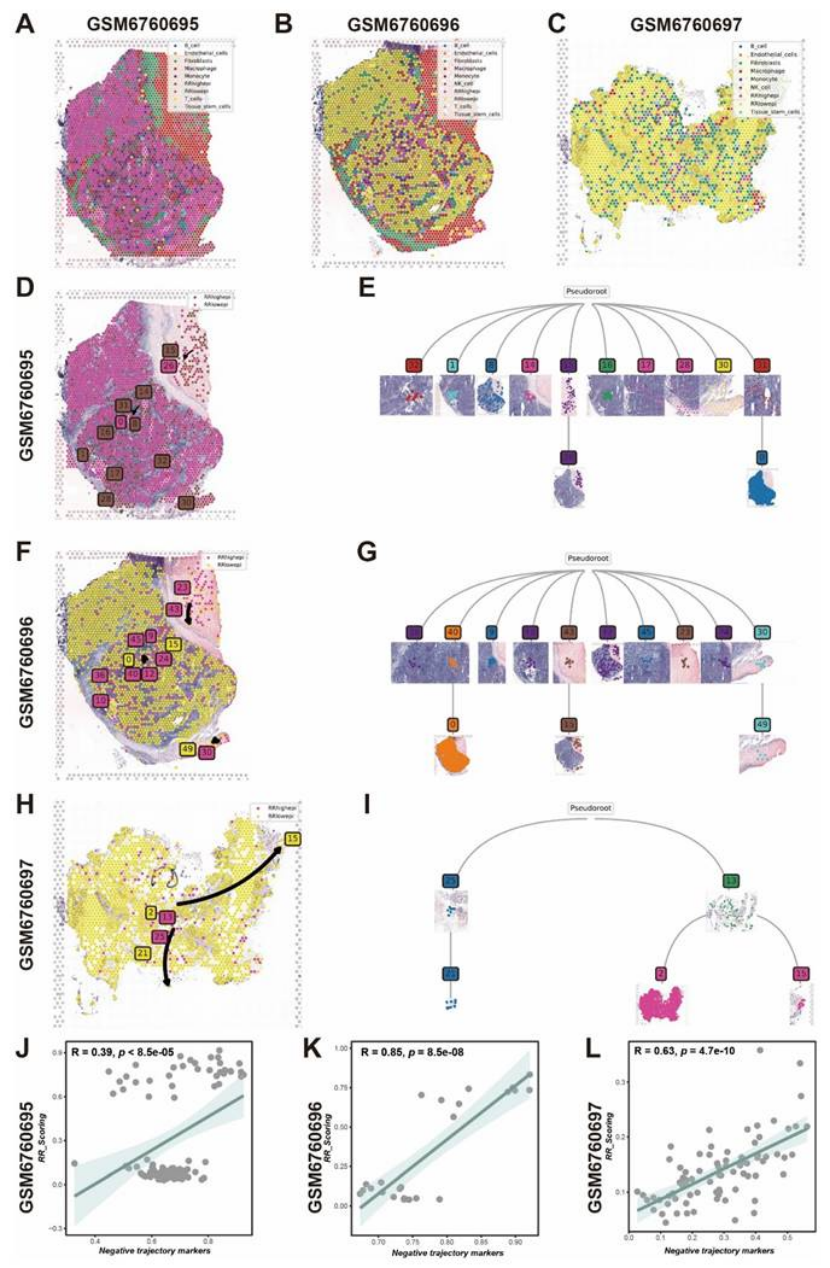
图6
医生发文启示:单细胞 + 空间转录组是 “精准定位” 的关键,能让你的研究从 “泛泛而谈” 升级为 “精准打击”,顶刊非常青睐这种 “细胞层面的机制拆解”。
第三步:孟德尔随机化 + 机器学习,构建临床可用的 SSRR 预后模型(图 7-9)
从“基础研究” 转向 “临床应用”,这一步是高分论文的 “加分项”:
因果验证:孟德尔随机化分析 24 个 GWAS 队列,证实 P4HA2、OCIAD2 等基因与乳腺癌存在因果关联(图 7A-D);
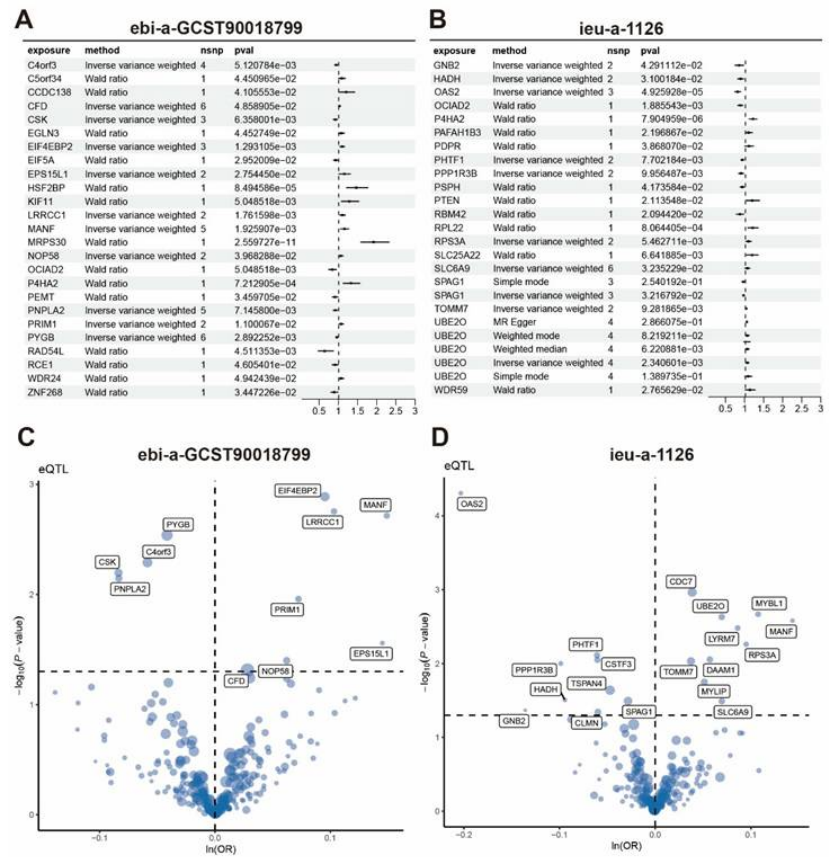
图7
模型构建:整合 RRhighepi 特征基因和孟德尔随机化结果,用 StepCox [both]+SuperPC 算法构建 SSRR 模型,基因权重最高的是 P4HA2(图 8B);
模型性能:在 TCGA 和 3 个外部队列中,高风险组患者生存显著更差(图 8C),2 年 AUC 最高 0.77,4 年 AUC 最高 0.73(图 8D-E),且是独立预后因素(HR=1.476,p<0.001,图 8K-P);

图8
治疗指导:高风险组对免疫治疗更敏感,且对多西他赛、多柔比星等化疗药敏感;低风险组对来曲唑、他莫昔芬更敏感(图9A-J)。
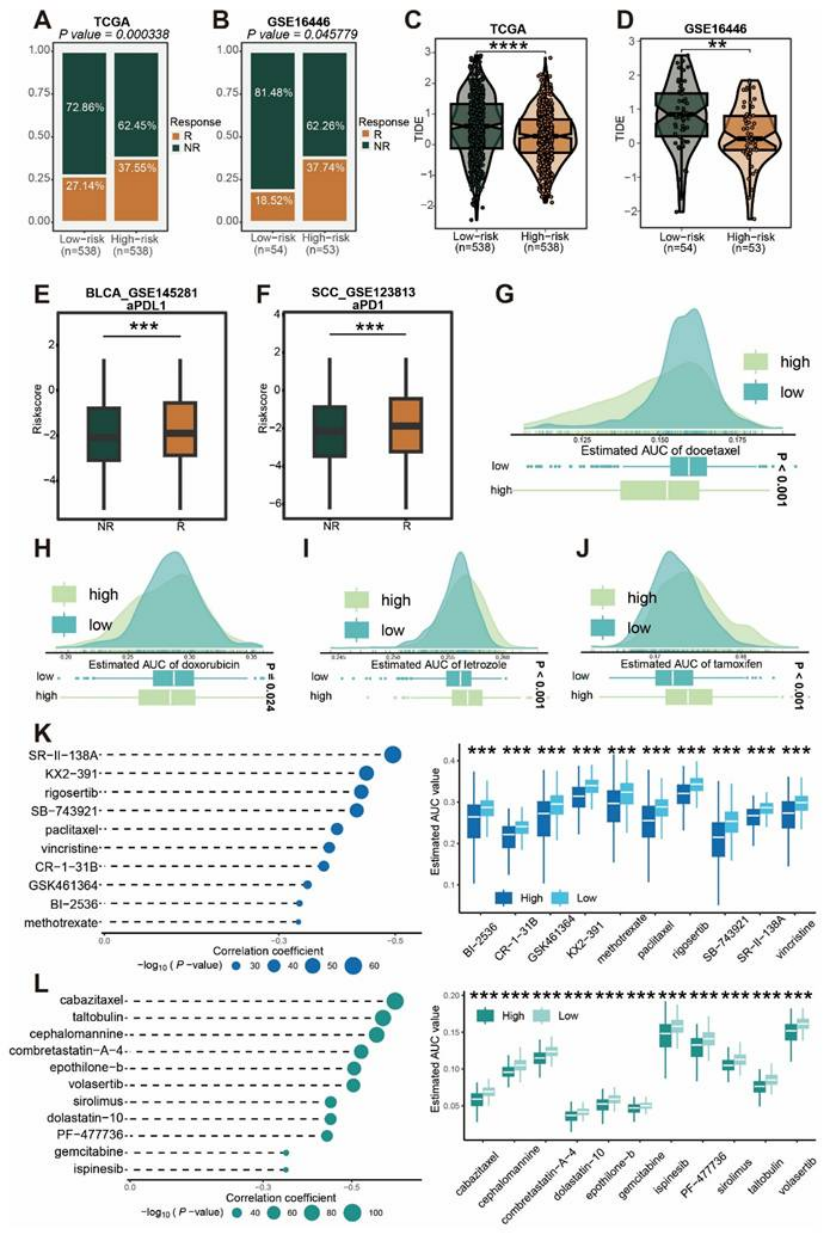
图9
医生发文启示:构建预后模型并验证其临床实用性,能大幅提升论文的转化价值,顶刊尤其看重“从实验室到病床” 的落地潜力。
第四步:多组学深挖 P4HA2 靶点,全方位证实其核心作用(图 10-12)
聚焦模型中权重最高的 P4HA2,用多组学验证其作为靶点的合理性:
泛癌表达:TCGA 转录组、CPTAC 蛋白质组、IHC 染色均证实,P4HA2 在乳腺癌等多种肿瘤中高表达,且恶性区域表达显著高于正常区域(图 10A-D、F-L);
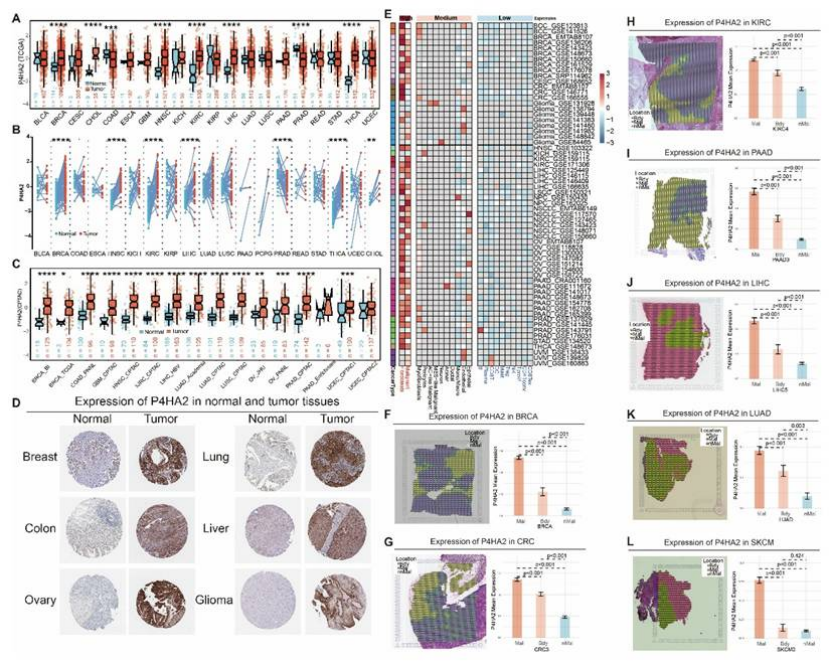
图10
临床关联:P4HA2 高表达与乳腺癌高分级、高分期(Stage IV 最高,图 12F-G)、HER2 亚型(表达最高,图 12H)显著相关,且是不良预后因素(图 12A-B);
分子特征:乳腺癌中 P4HA2 表达与甲基化负相关(图 11B),与基因组不稳定性(非整倍体、HRD 等)正相关(图 11H-L),转录因子 ESR1、BRD4 可能调控其表达(图 11N-O);
医生发文启示:靶点的“多维度验证” 是顶刊的硬要求,从转录组、蛋白质组、基因组、临床样本等层面交叉验证,才能证明靶点的可靠性。
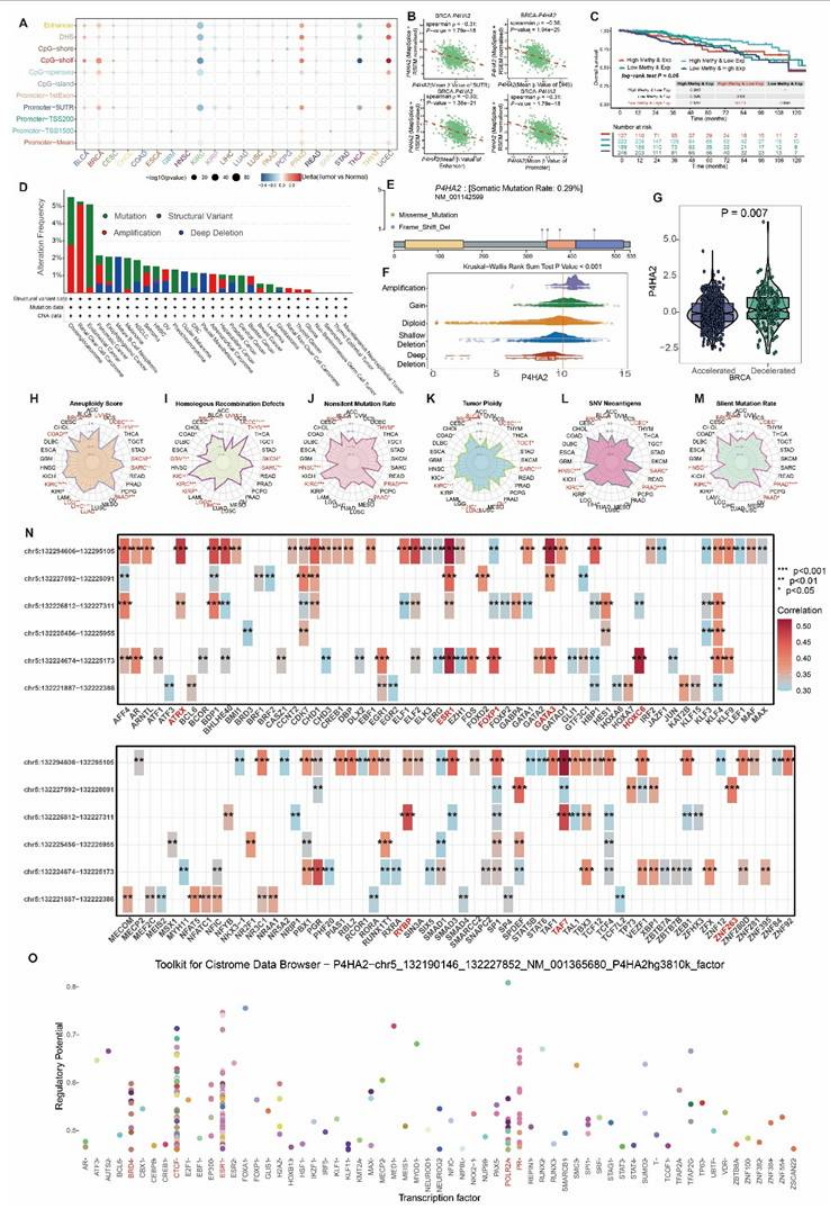
图11
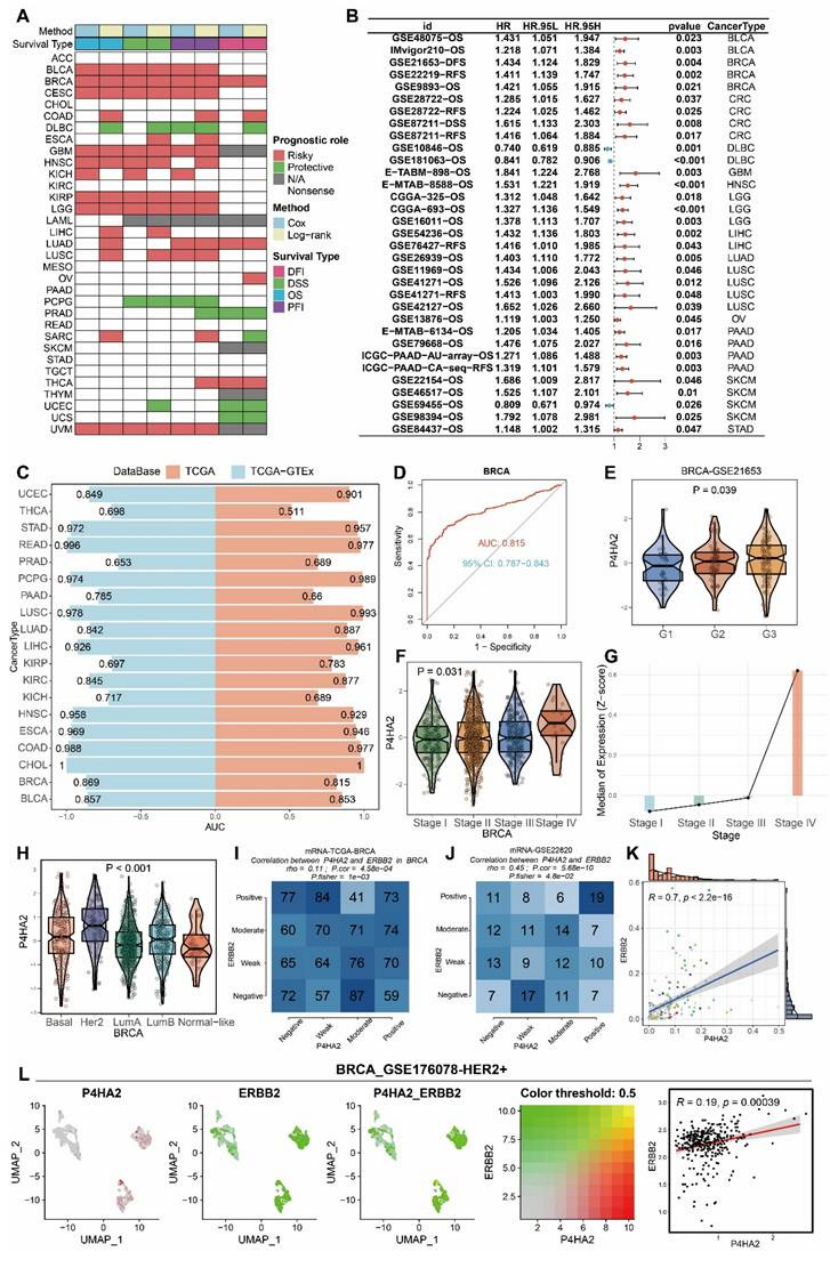
图12
第五步:体外实验验证,实锤 P4HA2 的放疗增敏作用(图 13-15)
基础研究最终要回归实验验证,这是医生发文避免“纯生信空壳” 的关键:
基础功能:敲低 P4HA2 后,HCC1606 和 MCF7 细胞的增殖(EdU assay)、迁移(Transwell)、克隆形成能力均显著降低(图 13C-L);
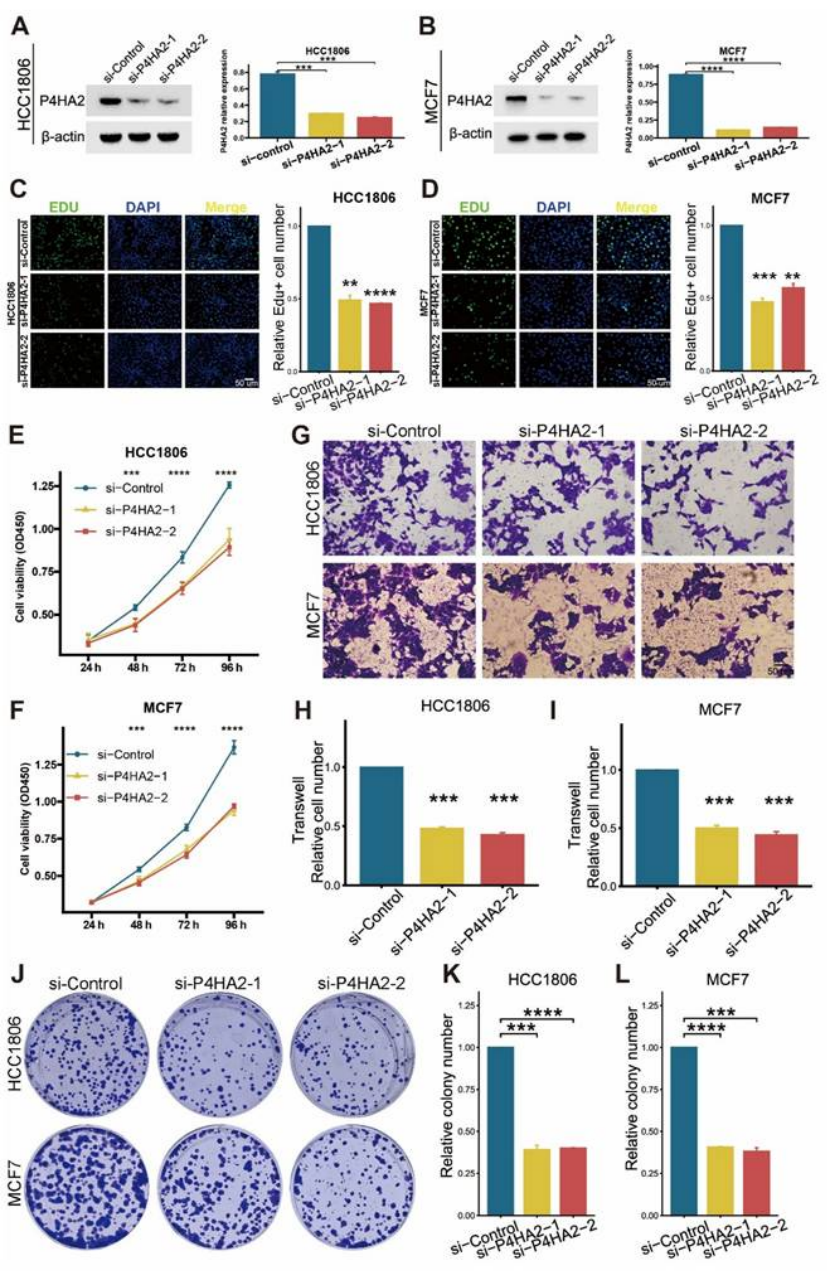
图13
放疗增敏:4Gy 放疗 + P4HA2 敲低组,癌细胞数量显著减少;6Gy 联合组几乎清零癌细胞(图 15A-C);
机制验证:联合治疗可降低干细胞标志物(CD44、Oct4)和 DNA 修复蛋白(KU80)表达,升高 DNA 损伤标志物(γ-H2AX),同时抑制 EMT(E-cadherin 升高,Vimentin 降低)(图 15D-Q、R-T);
WGCNA 验证:P4HA2 与放疗抵抗基因 panel 同属蓝色模块(占比 85.1%),且模块成员与抵抗特征显著相关(cor=0.52,p<1e-200,图 14G)。
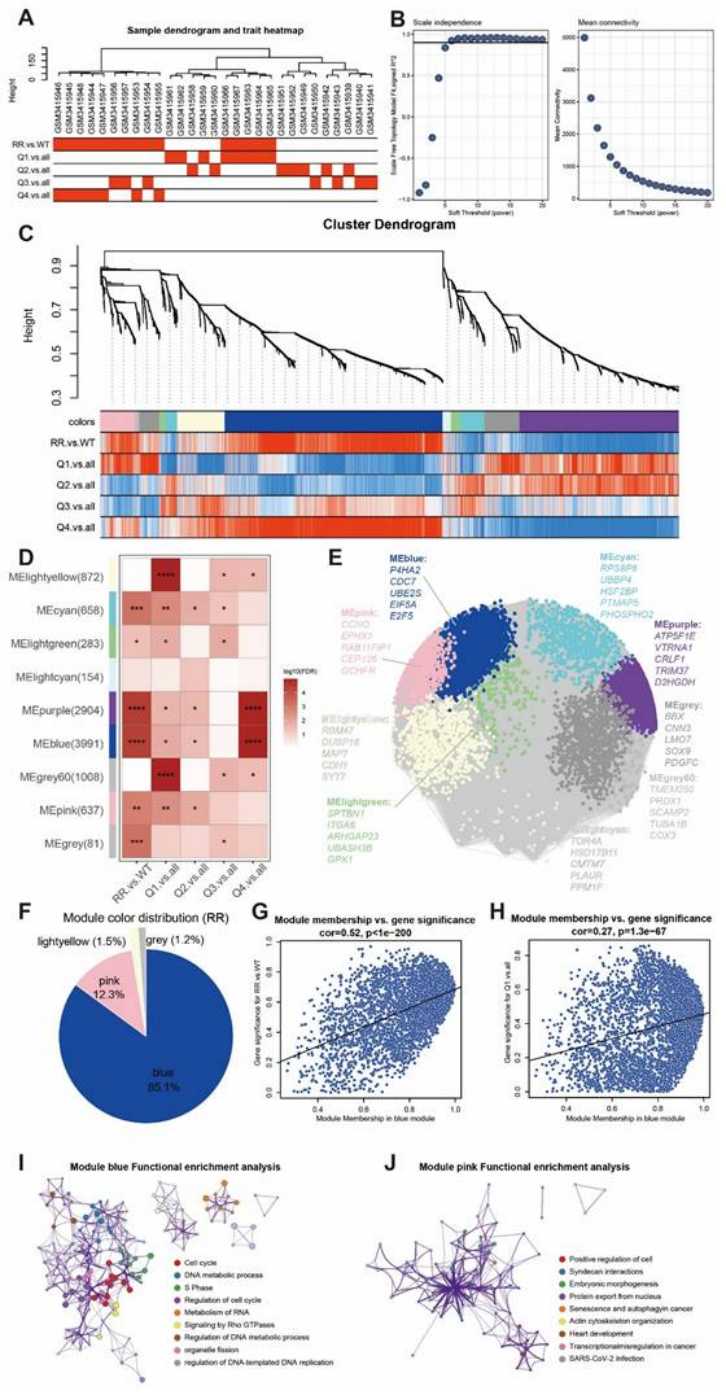
图14
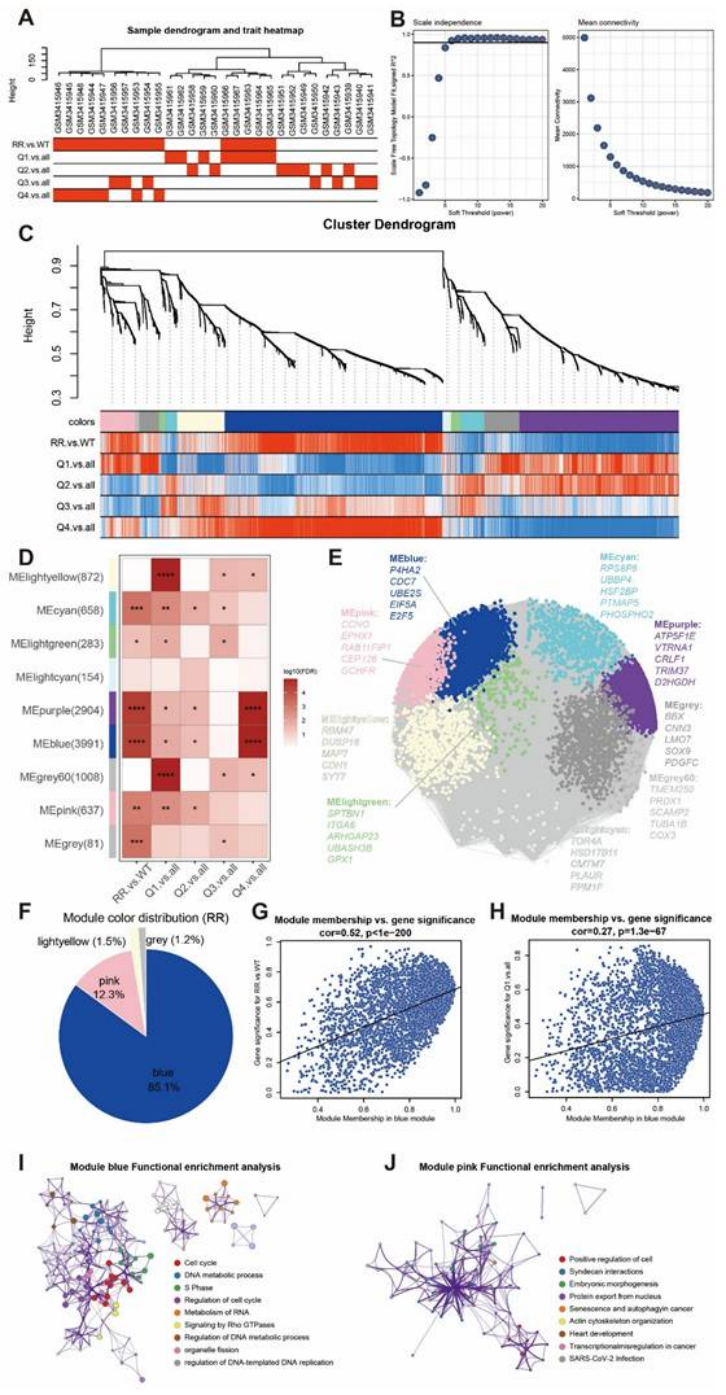
图15
医生发文启示:哪怕只有细胞实验,也能大幅提升论文的说服力,顶刊不喜欢“只谈理论不做实验” 的研究,基础实验是打通 “基础 - 临床” 的最后一公里。
临床价值:从科研到临床,每一步都有实际意义
对临床医生:① SSRR 模型可精准分层患者风险,指导治疗方案选择(高风险组选免疫治疗 + 化疗,低风险组选内分泌治疗);② P4HA2 可作为放疗抵抗的 biomarkers(乳腺癌诊断 AUC=0.813,图12D),帮助提前识别高危患者;
对科研人员:揭示“RRhighepi-P4HA2 - 细胞周期 / 代谢重编程 - 内皮细胞互作” 的全新机制(图 8),为后续研究提供方向;
对患者:P4HA2 抑制剂有望成为放疗增敏药物,尤其对 HER2 + 等放疗抵抗亚型,可能大幅提升治疗效果,降低复发风险。
这篇 IF=13.3 的顶刊,完美示范了临床医生如何做好多组学研究:
选题公式:临床痛点(放疗抵抗)+ 技术创新(单细胞 + 空间转录组)+ 转化价值(靶点 + 模型);
逻辑公式:公共队列找差异(bulk RNA-seq)→ 精准定位(单细胞 + 空间)→ 因果验证(孟德尔随机化)→ 模型构建(机器学习)→ 靶点验证(多组学 + 实验);
加分公式:多组学整合(避免单一技术)+ 实验验证(避免纯生信)+ 临床落地(模型 /biomarker)。
对于手握临床样本的医生来说,不用追求复杂的技术堆砌,而是要围绕一个临床问题,用多组学技术层层拆解,最后用实验验证核心结论,就能写出顶刊认可的好论文。
原文DOI: 10.7150/thno.121257
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号