
来源:特诺科研

文章信息速览
原标题:Targeting SPHK1 in macrophages remodels the tumor microenvironment and enhances anti-PD-1 immunotherapy efficacy in colorectal cancer liver metastasis
期刊:Top-tier Oncology Journal(IF=24.9)
关键词:结直肠癌肝转移(CRLM)、肿瘤相关巨噬细胞(TAM)、SPHK1、免疫联合治疗、NLRP3 炎症小体、IL-1β、ADAM17、抗 PD-1
研究目的
结直肠癌肝转移(CRLM)因免疫抑制微环境导致抗 PD-1 治疗应答率低,5 年生存率仅 14%。肿瘤相关巨噬细胞(TAMs)作为 TME 中最丰富的免疫细胞,异质性极强但调控机制不明。该研究聚焦 TAM 中鞘氨醇激酶 1(SPHK1),探究其对 CRLM 免疫逃逸的作用,验证靶向 SPHK1 联合免疫治疗的有效性,并通过多组学解析核心分子机制。
核心研究成果
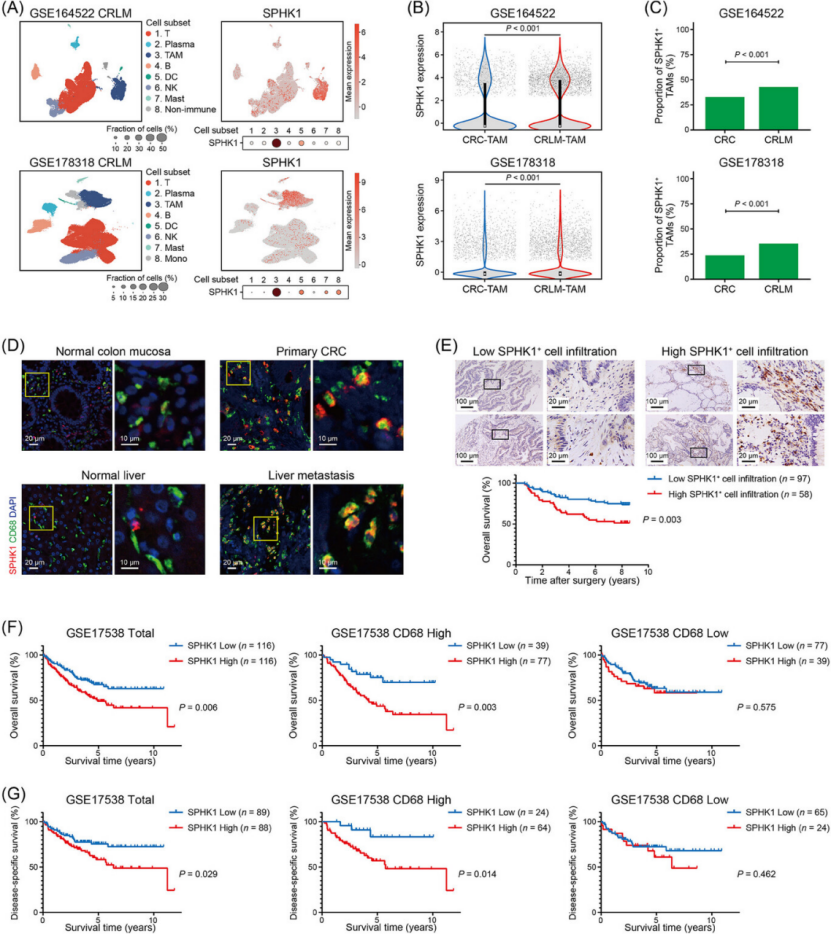
SPHK1 是 CRLM 不良预后标志物,特异性高表达于 TAMs(图 1)
人类样本验证:CRLM 组织中 SPHK1+ TAMs 浸润量显著高于正常肝组织、原发结直肠癌组织(图 1D),与患者淋巴结转移、TNM 分期正相关。
预后价值:SPHK1+ TAMs 高浸润者总生存期(OS)显著缩短(图 1E),是 CRC 患者独立预后风险因素;尤其在 CD68+ TAM 高浸润人群中,SPHK1 高表达者 OS 和疾病特异性生存期(DSS)更差(图 1F、G)。
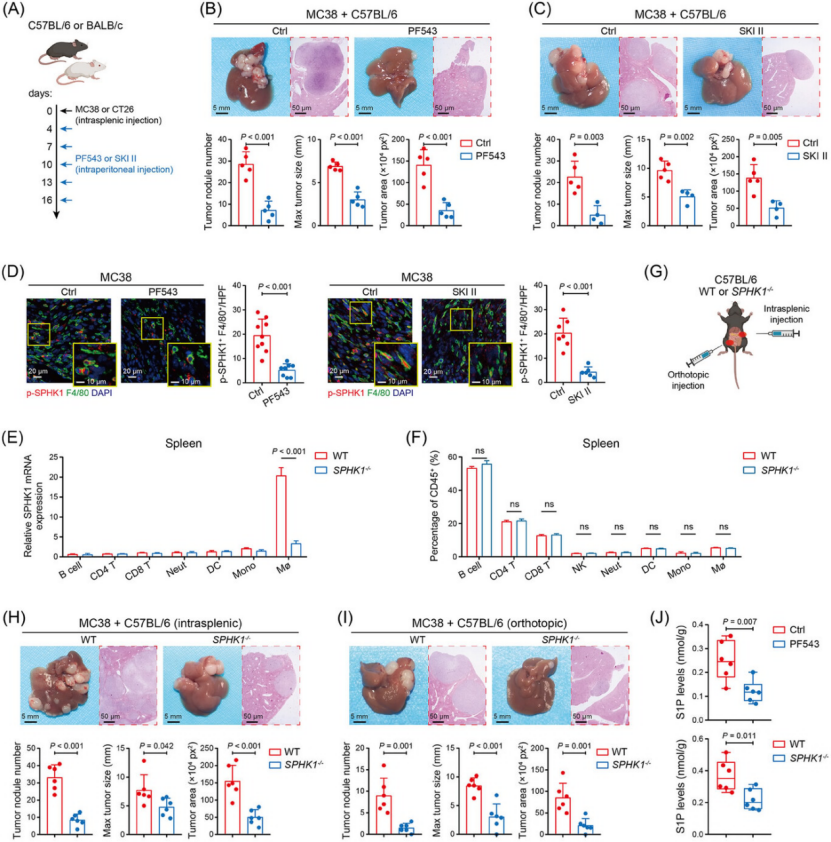
靶向 SPHK1(药物 / 基因敲除)显著抑制 CRLM 进展,安全性拉满(图 2)
体内实验:SPHK1 抑制剂(PF543/SKI II)处理或 SPHK1 敲除(SPHK1−/−)小鼠,肝转移灶数量、直径显著减少(图 2B、C、H、I),生存期延长,且对小鼠体重、肝肾功能无明显影响(无脱靶毒性)。
机制佐证:SPHK1 缺陷或抑制后,肝肿瘤中 SPHK1 底物 S1P 浓度显著降低(图 2J),证实靶向通路特异性。
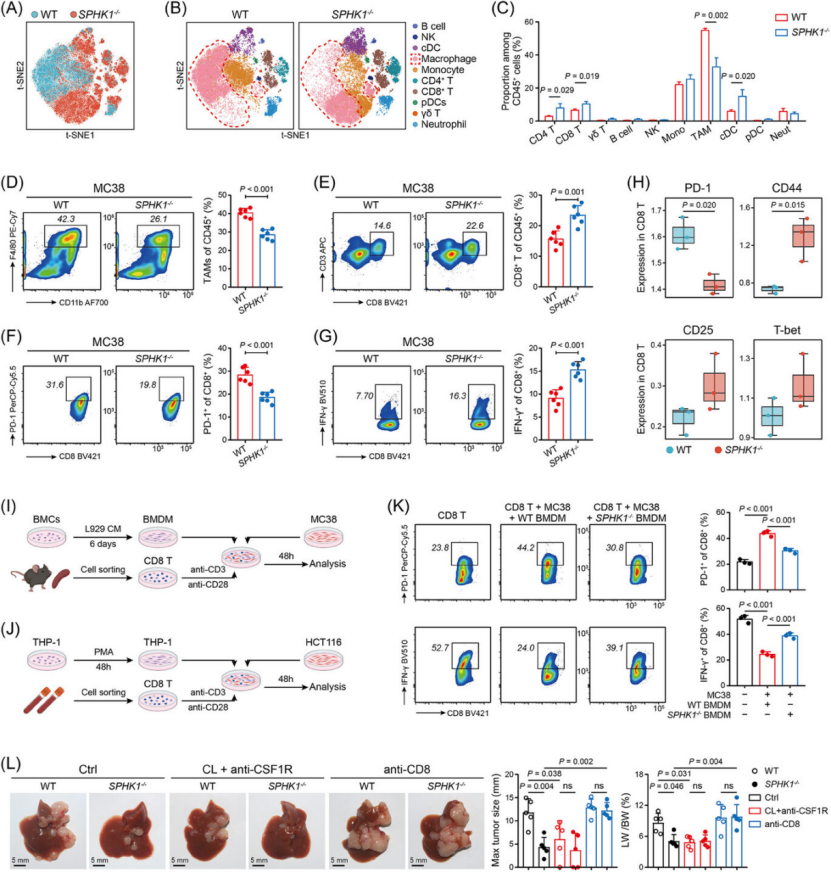
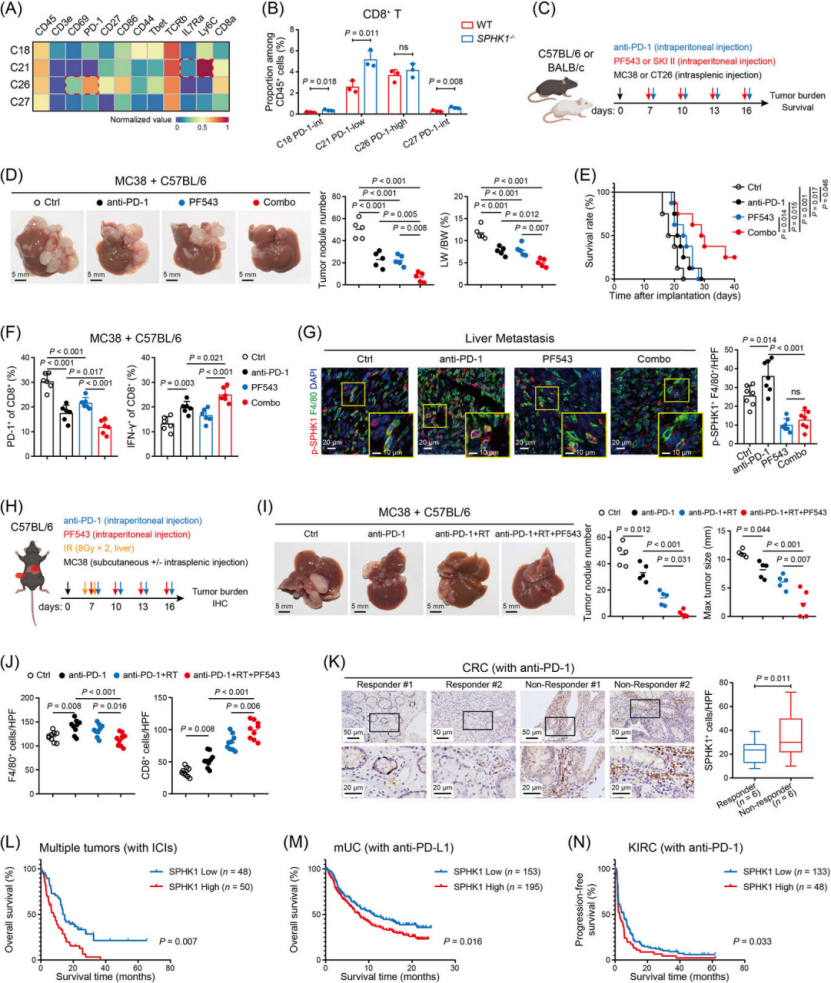
重塑免疫抑制 TME:逆转 CD8+ T 细胞耗竭,增强 antitumor immunity(图 3)
CyTOF 单细胞分析:SPHK1−/−小鼠肝肿瘤中,CD8+ T 细胞比例升高,TAM 比例降低(尤其免疫抑制亚型 C11/C12/C13)(图 3A-C)。
T 细胞功能修复:SPHK1 缺陷后,CD8+ T 细胞 PD-1/LAG3/TIM3 等耗竭标志物表达降低,IFN-γ、颗粒酶 B(GZMB)等效应分子表达升高(图 3F、G),且 CD62L + 记忆样 T 细胞比例增加(免疫治疗敏感表型)。
体外验证:SPHK1 敲除巨噬细胞与 CRC 细胞、CD8+ T 细胞共培养,显著提升 CD8+ T 细胞杀伤活性(图 3K),TAM/CD8+ T 细胞耗竭是该效应的核心依赖(图 3L)。
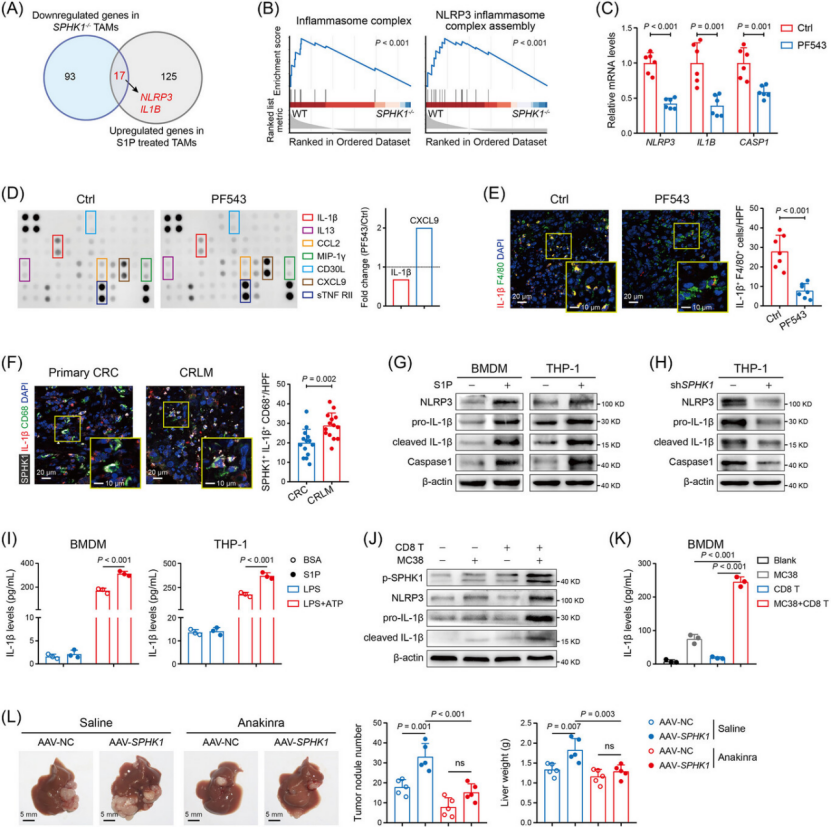
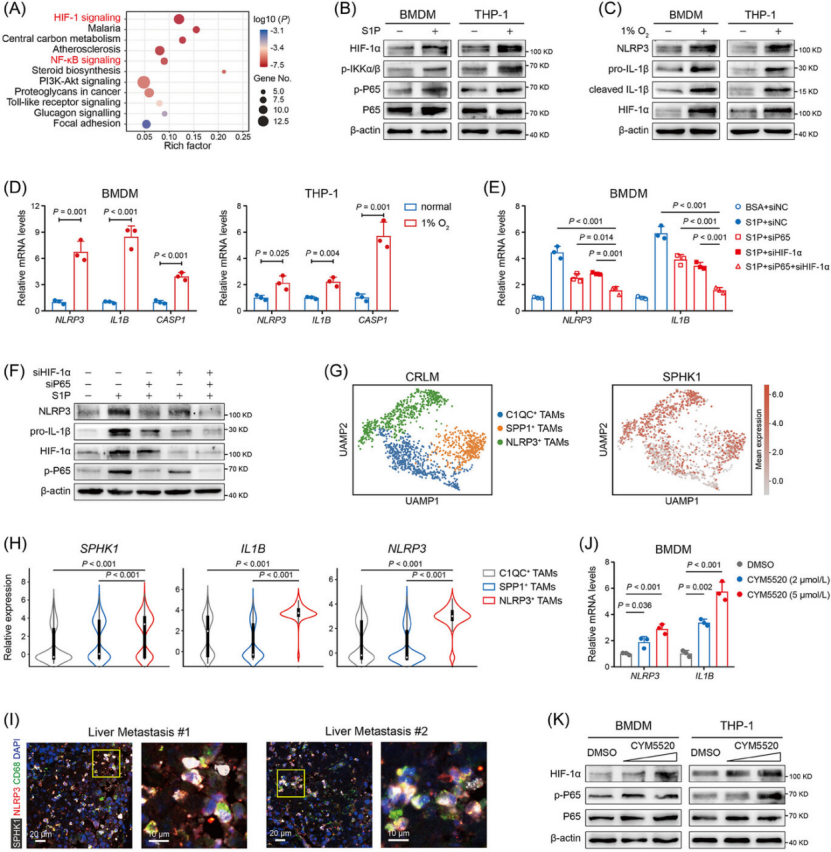
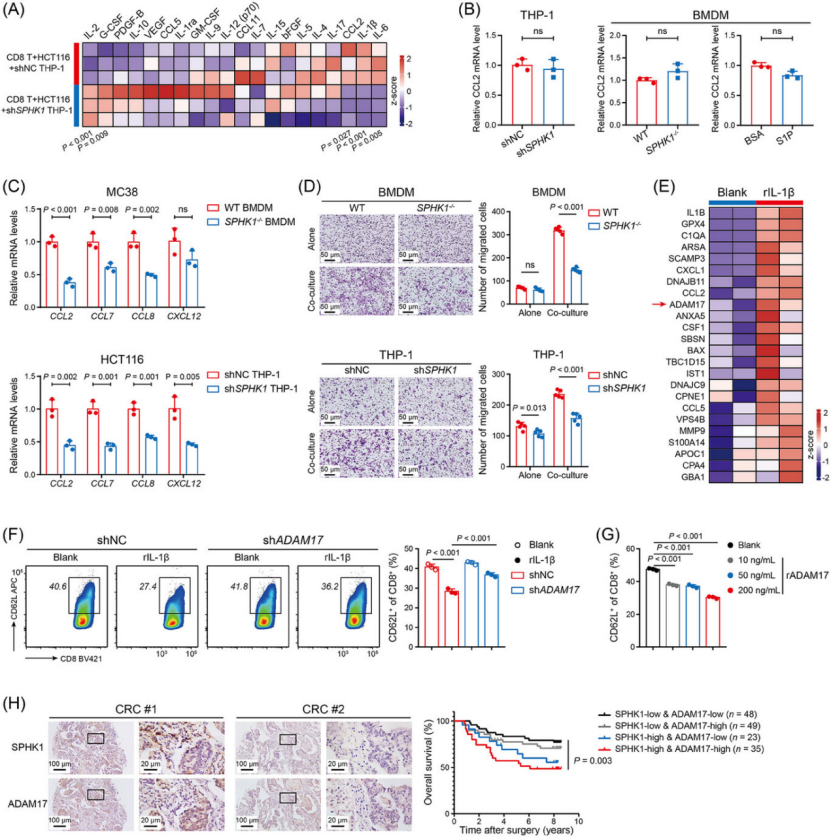
机制闭环:SPHK1-S1PR2-NF-κB/HIF-1α-NLRP3-IL-1β-ADAM17 通路(图 4-6)
上游信号:SPHK1 产生的 S1P 通过自分泌结合 TAM 表面 S1PR2,激活 NF-κB 和 HIF-1α 信号(图 5B、J、K)。
核心介质:NF-κB/HIF-1α 共同驱动 NLRP3 炎症小体激活,促进 IL-1β 分泌(图 4A、B、G);CRC 细胞与 CD8+ T 细胞共培养时,IFN-γ 进一步增强 SPHK1 磷酸化和 IL-1β 释放(图 4J、K)。
下游效应:IL-1β 旁分泌作用于 CRC 细胞,一方面诱导 CCL2/CCL7/CCL8 等趋化因子分泌,招募更多 TAM 浸润;另一方面促进 ADAM17 释放(图 6E),ADAM17 直接切割 CD8+ T 细胞表面 CD62L,导致其迁移和杀伤功能障碍(图 6F、G)。
联合治疗奇效:SPHK1 抑制剂 + 抗 PD-1 / 放疗,疗效翻倍且减毒(图 7)
双药联合:SPHK1 抑制剂(PF543/SKI II)+ 抗 PD-1 治疗,较单药显著减少肝转移灶(图 7D),延长小鼠生存期(图 7E),且进一步降低 CD8+ T 细胞 PD-1 表达、提升 IFN-γ 分泌(图 7F)。
三药联合:抗 PD-1 + 肝放疗 + PF543,较双药更显著抑制肝转移(图 7I),同时减轻放疗相关肝损伤(ALT/AST 水平降低,髓系细胞浸润减少)(图 7H、J)。
临床预测:CRLM 患者中 SPHK1 高表达与 TIDE 高分(免疫治疗无应答表型)正相关,SPHK1 高表达者接受 ICI 治疗后 OS/PFS 更差(图 7L-N),可作为 ICI 疗效预测标志物。
研究核心逻辑总结
临床痛点切入:瞄准 CRLM 免疫治疗耐药难题,锁定 TAM 这一核心免疫抑制细胞,筛选出 SPHK1 这一特异性靶点。
多组学 + 多维验证:整合 RNA-seq、CyTOF、蛋白组、IHC/IF、体内外功能实验,从 “靶点筛选 - 功能验证 - 机制解析 - 临床转化” 形成完整闭环。
转化价值突出:既明确 SPHK1 作为 CRLM 预后和 ICI 疗效预测标志物,又提供 “SPHK1 抑制剂 + 抗 PD-1 / 放疗” 的联合治疗方案,兼具诊断和治疗价值。
机制创新:首次揭示 SPHK1 在 TAMs 中通过 “S1PR2-NF-κB/HIF-1α-NLRP3-IL-1β-ADAM17” 通路调控 CD8+ T 细胞功能,为 TAM 靶向治疗提供新范式。
原文DOI: 10.1002/cac2.70047
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!

PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号