
来源:特诺科研
脓毒症作为重症医学领域的“头号杀手”,全球年发病超4900万,死亡率近20%,但长期缺乏精准的biomarker与靶向治疗方案。
近日,山东第一医科大学附属省立医院重症医学科团队在《International Journal of Surgery》(IF=10.3,顶刊)发表重磅研究,通过“多组学筛选+临床队列验证+动物实验”三重体系,首次证实载脂蛋白E(ApoE)是脓毒症的双相调控因子——无论是过低还是过高,都会显著增加脓毒症风险,且仅20%作用依赖脂质代谢,为脓毒症的精准分层与靶向治疗提供了全新突破口!这篇整合多组学与临床转化的典范论文,值得所有重症、急诊、检验科医生重点关注。

核心信息速览
原标题:Plasma Apolipoprotein E as a Biphasic Modulator of Sepsis Risk: A Multi-Omics and Experimental Validation Study
期刊:International Journal of Surgery(IF=10.3,外科领域顶刊,开放获取)
关键词:脓毒症, 载脂蛋白E, 生物标志物, 多组学, 非线性效应
直击临床痛点+研究设计闭环
脓毒症的临床诊疗长期面临两大难题:一是诊断依赖SOFA、qSOFA等非特异性标准,易延误病情;二是传统biomarker(如PCT、CRP)仅反映泛炎症,无法精准关联病理机制。而该研究精准切入这一缺口,设计了“多组学筛选-因果验证-临床落地-机制解析”的完整闭环,每一步都踩中顶刊核心需求:
1. 筛选体系够严谨:突破单一队列局限,整合deCODE、Fenland、FinnGen、UK Biobank等5个国际大型队列,从226个蛋白中锁定ApoE,经MR、SMR、贝叶斯共定位等多重因果分析验证,排除混杂因素,确保结果可靠性;
2. 临床证据够扎实:纳入291例ICU患者(154例脓毒症+137例SIRS对照),通过logistic回归、限制性立方样条等分析,明确ApoE的U型关联,且在不同性别、年龄分层中均稳定存在;
3. 转化价值够突出:不仅证实ApoE可作为脓毒症分层biomarker,还通过分子对接筛选出4种潜在靶向药物,同时开发联合评分模型,直接为临床诊疗提供工具。
4大核心发现,颠覆对ApoE的认知
研究团队通过层层递进的分析,揭示了ApoE调控脓毒症的完整逻辑,每一项发现都有扎实数据支撑:
发现一:多组学锁定ApoE,是脓毒症的“因果关联蛋白”
团队通过MR和SMR分析5个大型pQTL数据集,从226个候选蛋白中,发现ApoE是唯一在3个独立数据集(UKB-PPP、Fenland、FinnGen-Olink)中均满足“FDR<0.05+HEIDI P>0.05”的蛋白。贝叶斯共定位分析进一步证实,ApoE蛋白位点与脓毒症风险位点存在共享因果变异(PP.H4>0.80,如图1C-H),明确ApoE与脓毒症并非简单关联,而是存在因果关系。
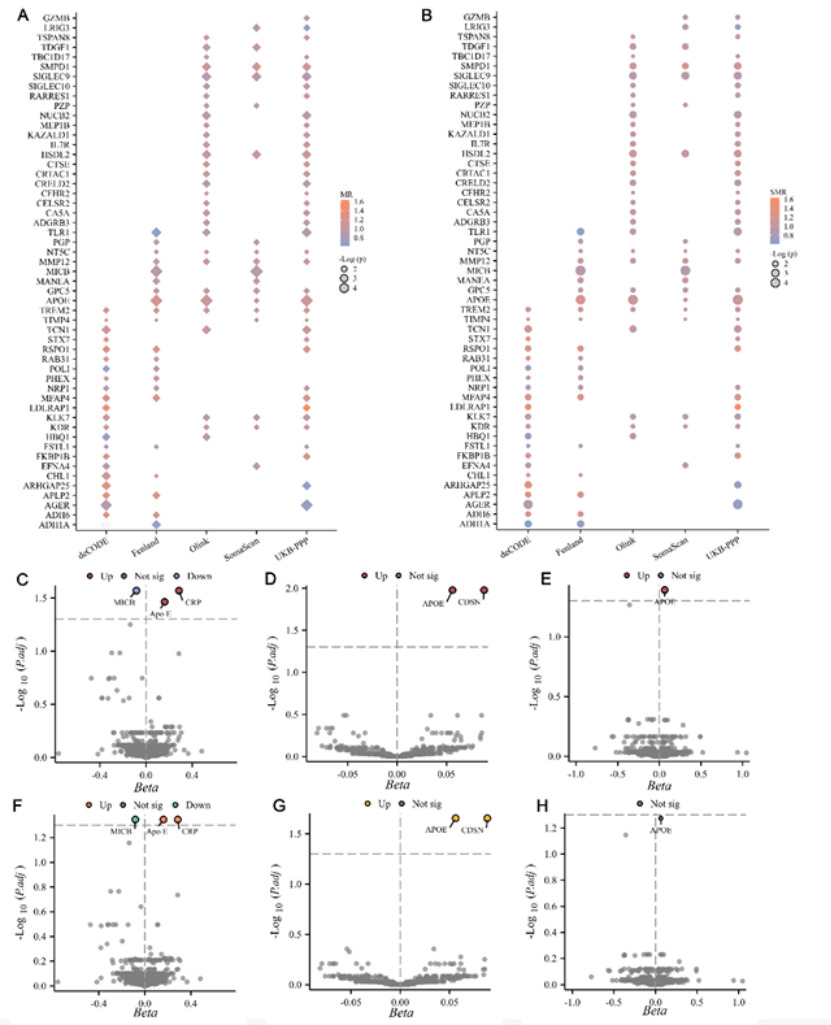
图1
同时,PPI网络分析(如图2F、图3A所示)显示,ApoE是脓毒症相关蛋白网络的核心枢纽,直接与LDLRAP1、CRP等关键分子互作,连接脂质代谢、炎症信号两大功能模块,提示其在脓毒症病理机制中的核心地位。
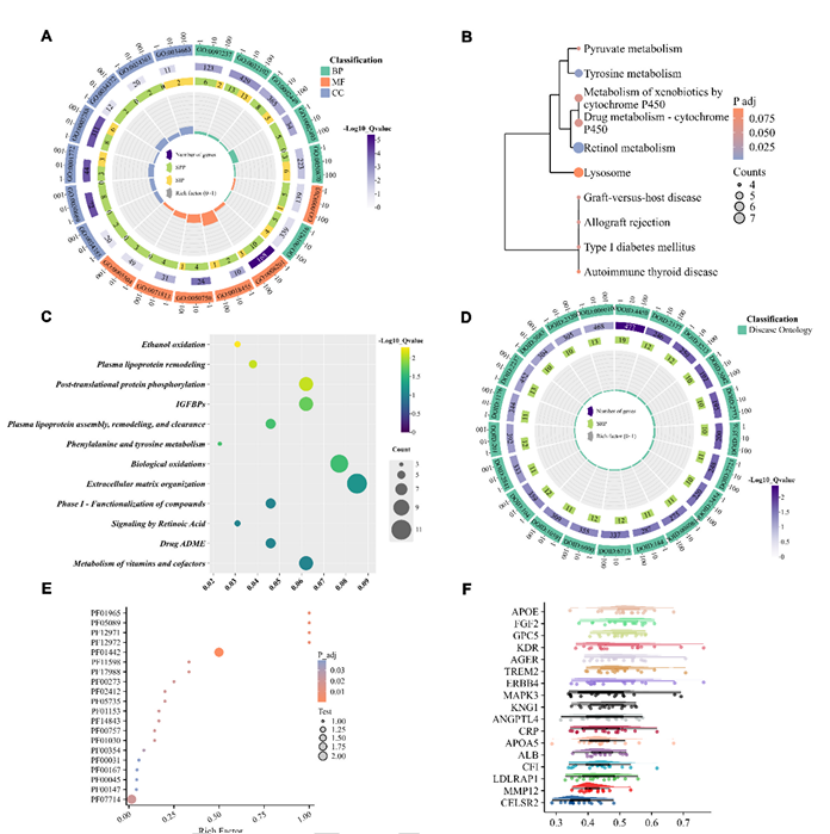
图2
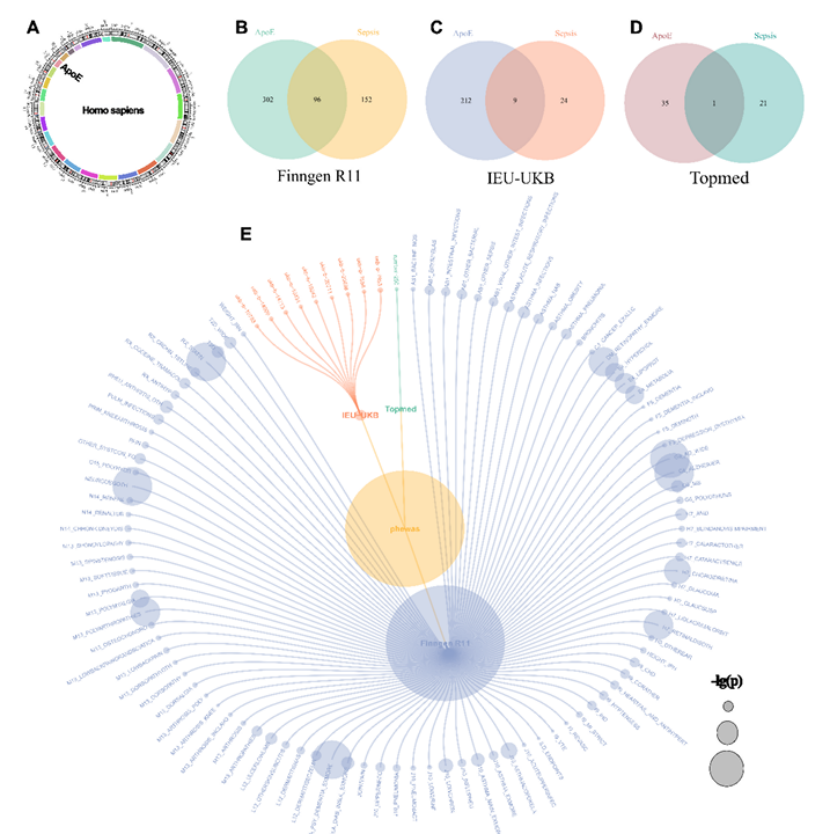
图3
发现二:临床队列证实,ApoE呈“U型”调控脓毒症风险
在291例ICU患者队列中,脓毒症患者的ApoE水平呈现明显“双峰分布”:51.95%为低表达,35.71%为高表达,而SIRS对照组56.20%为中等表达(P<0.001)。
多因素logistic回归分析显示:与中等ApoE水平相比,低ApoE组脓毒症风险调整后OR=12.74(95%CI 5.72-28.36),高ApoE组OR=4.54(95%CI 2.25-9.16),且限制性立方样条分析(如图4B-E所示)证实这种U型关联具有统计学显著性(P_nonlinear<0.001)。更重要的是,这种关联在不同性别、年龄(<60岁/≥60岁)分层中均稳定存在,说明其具有广泛适用性。
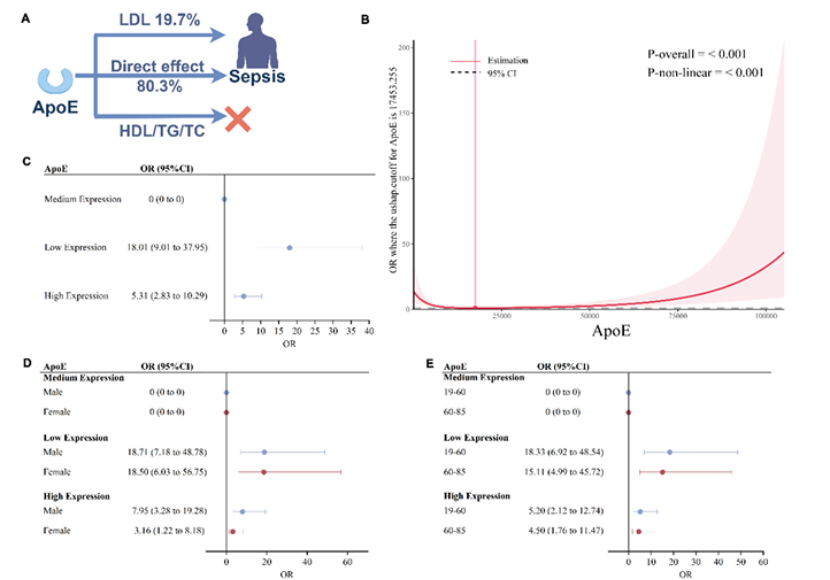
图4
发现三:动物实验验证,ApoE“过高/过低”都加重脓毒症
为明确ApoE的调控作用,团队构建了三种小鼠模型:ApoE敲除(低表达)、野生型CLP(中等表达)、重组ApoE处理(高表达),并设置假手术对照。结果显示:
1. 生存曲线(如图5A所示):中等ApoE组120小时生存率最高,低/高ApoE组生存率显著下降(log-rank P=0.002),假手术组生存率100%;
2. 炎症水平(如图5B-F所示):低ApoE组TNF-α、IL-6、IL-1β等促炎因子峰值最高,高ApoE组IFN-γ水平显著升高,且抗炎因子IL-10无法抵消促炎负担;
3. 器官损伤(如图5G所示):低ApoE组出现严重肺损伤、肝细胞肿胀、脾淋巴细胞耗竭,高ApoE组出现中度肺水肿和肝损伤,中等ApoE组器官结构基本完整。
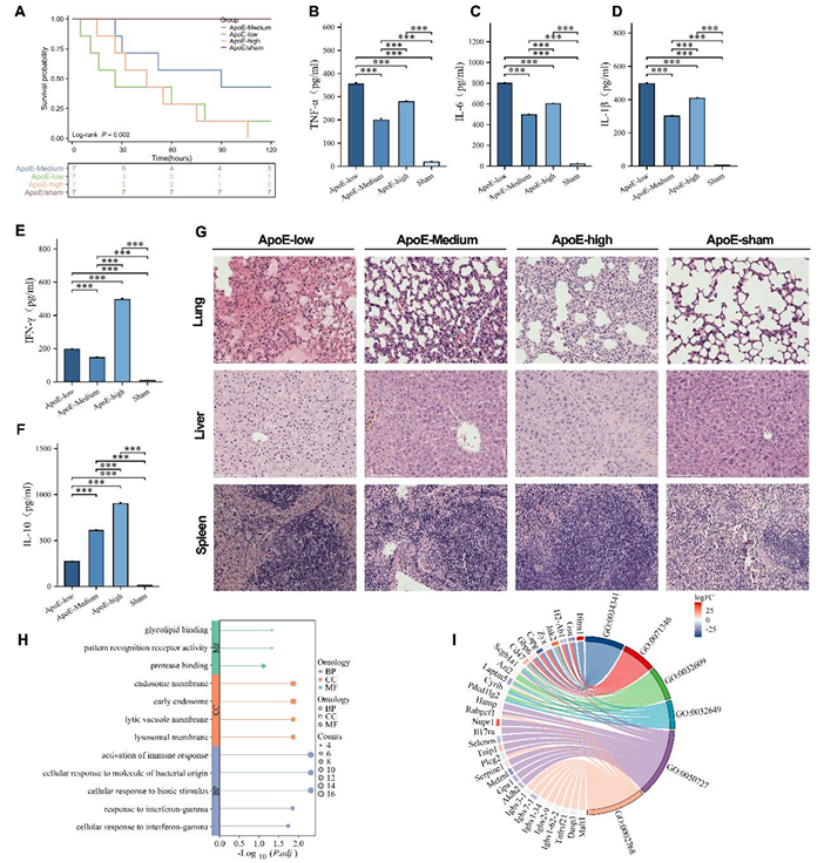
图5
发现四:机制突破,仅20%依赖脂质,80%为脂质非依赖机制
传统认知中,ApoE主要参与脂质转运,但该研究通过两步MR介导分析(如图4A所示)发现,LDL-C仅介导了19.7%的ApoE-脓毒症关联,其余80.3%的作用依赖脂质非依赖机制。
转录组分析(如图5H-I所示)进一步揭示,高ApoE组小鼠的外周血中,I型干扰素信号、抗原呈递、氧化应激反应等通路显著上调,提示ApoE可能通过调控免疫应答而非单纯脂质代谢,参与脓毒症的发生发展。这一发现颠覆了对ApoE功能的传统认知,为靶向治疗提供了新方向。
临床与科研双重价值:这篇论文能为医生带来什么?
1. 临床诊疗层面:① 提供精准分层工具:ApoE水平可作为脓毒症的“风险分层biomarker”,识别低/高表达的高危患者;② 优化诊断模型:ApoE联合SOFA评分的RCS模型AUC达0.842,显著优于单独SOFA评分(AUC=0.745),可直接用于临床鉴别脓毒症与非感染性炎症;③ 提供靶向方向:筛选出的4种ApoE结合化合物(如Abequolixron、PH-002等),为脓毒症的精准治疗提供了候选药物。
2. 科研设计层面:提供“多组学筛选-因果验证-临床+动物双模型验证-机制解析”的完整研究范式,尤其适合重症、急诊、检验科医生开展biomarker相关研究。对于有临床队列资源的团队,可直接复用该框架,研究其他疾病的潜在biomarker。
3. 学术价值层面: reconcile了此前关于ApoE与脓毒症关系的争议(部分研究认为ApoE保护,部分认为有害),明确其“双相调控”特性,为脓毒症的病理机制研究提供了新的理论依据。
总结:脓毒症精准诊疗的新里程碑,ApoE成核心突破口
山一大附属省立医院重症医学科团队的这项研究,以IF=10.3的顶刊成果,为脓毒症的诊疗带来了革命性突破:通过多组学技术锁定ApoE这一核心调控因子,证实其U型双相调控脓毒症风险,明确脂质非依赖的核心机制,并开发出可直接用于临床的分层与诊断工具。
对于临床医生而言,这意味着未来可通过检测ApoE水平,精准识别脓毒症高危患者,制定个体化治疗方案;对于科研人员而言,该研究提供的“多组学+双模型”范式,是开展biomarker研究的好案例。
原文DOI: 10.1097/JS9.0000000000004141
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!


PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号