
来源:特诺科研
前列腺癌(PCa)是男性高发恶性肿瘤,晚期患者依赖多西他赛等化疗药物,但耐药率居高不下,50% 以上患者最终进展为转移性癌症。近年来,高脂饮食(HFD)与肥胖被证实是前列腺癌进展和耐药的关键风险因素,但背后的分子机制一直未被阐明。近日,中山大学附属第七医院等团队在《Cancer Letters》(IF=10.1,肿瘤领域顶刊,开源获取)发表重磅研究:通过临床队列、单细胞分析、3D 生物凝胶模型、动物实验及多组学技术,首次揭示 “高脂饮食→TGF-β1 分泌→CAFs 激活→ECM 僵硬→Piezo1 介导钙稳态失衡→线粒体 - ER 接触(MERCs)异常→代谢重编程” 的完整耐药通路,证实双靶向脂质代谢(他汀类)和机械信号(Piezo1 抑制剂 GsMTx4)可协同逆转化疗耐药,为晚期前列腺癌精准治疗提供全新策略!
文章信息速览
原标题:High-fat diet induced ECM remodeling attenuates chemosensitivity in prostate cancer via activating Piezo1-dependent mitochondria-ER contacts
期刊:Cancer Letters(IF=10.1,肿瘤领域顶刊,开源获取)
关键词:前列腺癌(PCa)、高脂饮食(HFD)、化疗耐药、细胞外基质(ECM)僵硬、Piezo1、线粒体 - ER 接触(MERCs)、癌症相关成纤维细胞(CAFs)、他汀类、GsMTx4、TGF-β1
研究背景与临床痛点
治疗困境:晚期前列腺癌化疗(如多西他赛)耐药率高,仅 50% 患者获益,转移性前列腺癌患者预后差;
风险关联:高脂饮食、肥胖与前列腺癌进展、耐药密切相关,但“饮食 - 肿瘤微环境 - 耐药” 的分子桥梁未被明确;
机制盲区:ECM 僵硬是恶性肿瘤的典型特征,但在前列腺癌化疗耐药中的作用及调控通路尚不清楚;
治疗短板:传统化疗仅针对肿瘤细胞,忽略肿瘤微环境的“保护作用”,缺乏靶向微环境的联合治疗方案。
研究核心亮点
这篇顶刊研究的成功关键在于“从临床现象切入,用多模型验证,最终落地临床可行的联合疗法”,5 大核心步骤完美契合肿瘤领域顶刊逻辑,关键图表直观支撑结论:
1. 第一步:临床队列 + 单细胞分析,锁定高脂饮食与前列腺癌恶性进展的关联(图 1)
临床数据:72 例前列腺癌患者中,高脂血症患者高 Gleason 评分(GS8-10)占比 67.5%,显著高于非高脂血症患者;高胆固醇、高甘油三酯与 Gleason 评分正相关(图 1a-c);
单细胞分析:整合公共数据库 HSPC 和 CRPC 单细胞数据,发现 CRPC 中肿瘤细胞脂质代谢通路显著富集,且成纤维细胞(ECM 主要来源)数量大幅扩张(图 1f-l);
动物实验验证:高脂饮食小鼠的前列腺癌移植瘤生长速度显著快于正常饮食组,他汀类药物可逆转这一效应(图 1d-e、n),证实脂质代谢紊乱的促癌作用。
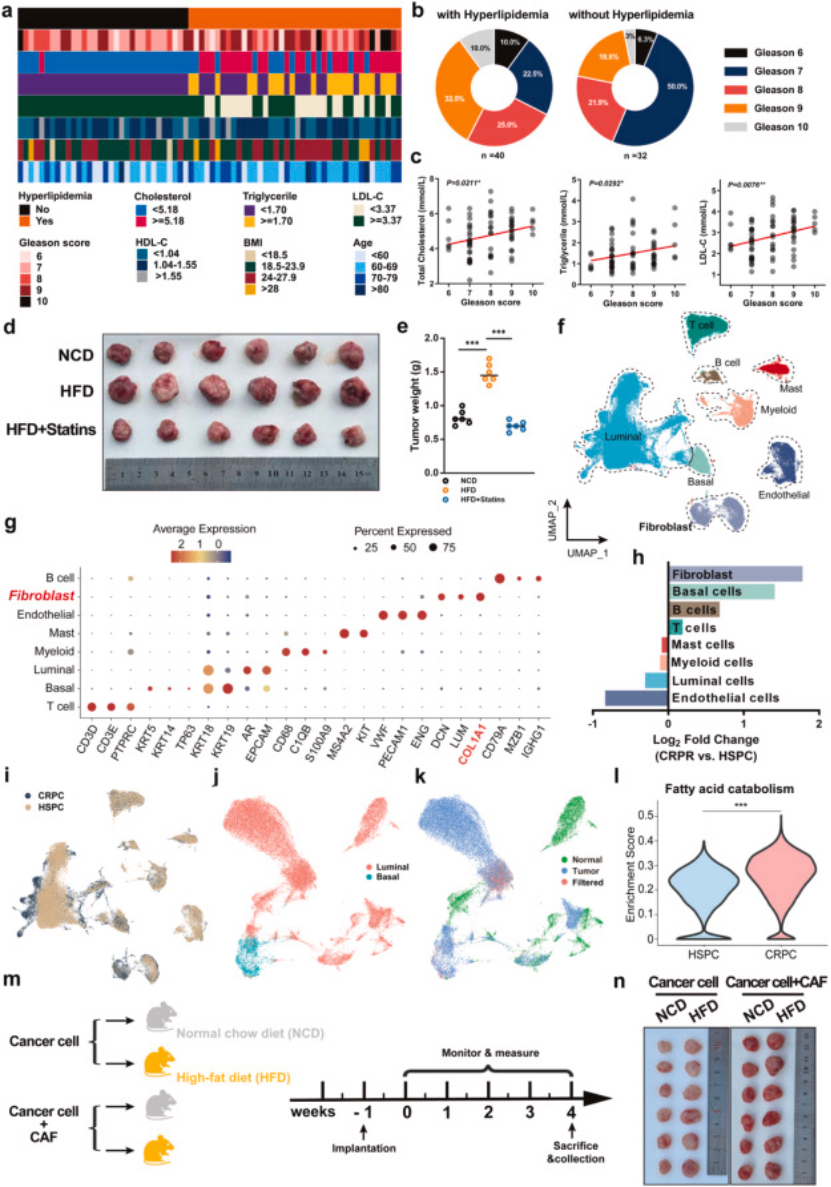
图1
2. 第二步:机制解析,高脂饮食通过 TGF-β1 间接激活 CAFs,驱动 ECM 僵硬(图 2、3)
关键发现:高脂饮食不直接激活 CAFs(体外直接用脂肪酸处理 CAFs,α-SMA、FAP 等激活标志物无显著变化,图 3b-d);
核心机制:高脂环境诱导前列腺癌细胞分泌 TGF-β1(ELISA 证实其分泌量翻倍,图 3g-i),TGF-β1 作为 “信使” 间接激活 CAFs;
下游效应:活化的 CAFs 大量分泌胶原,导致 ECM 胶原沉积、交联增加,原子力显微镜(AFM)证实,高脂饮食 + CAFs 组肿瘤组织硬度显著高于对照组(图 2c-d),Masson 染色、天狼星红染色均验证了 ECM 僵硬表型(图 2e-f、q-r)。
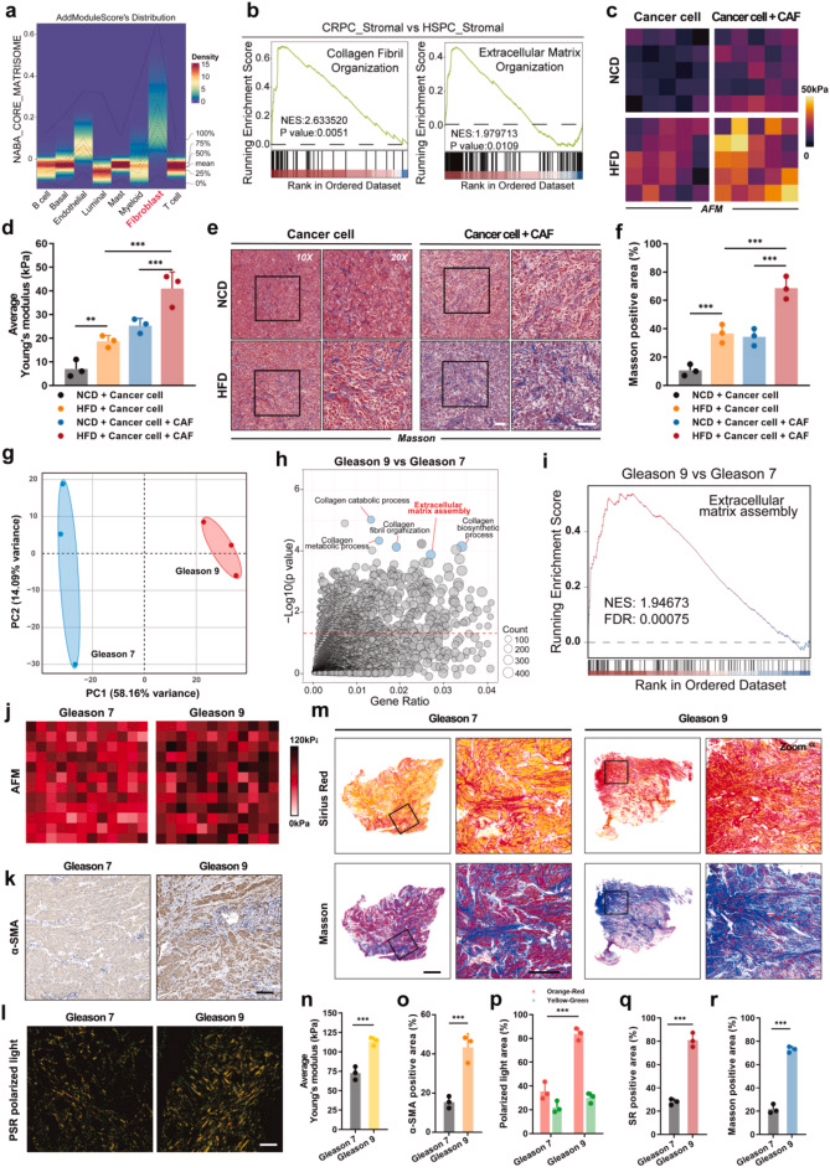
图2
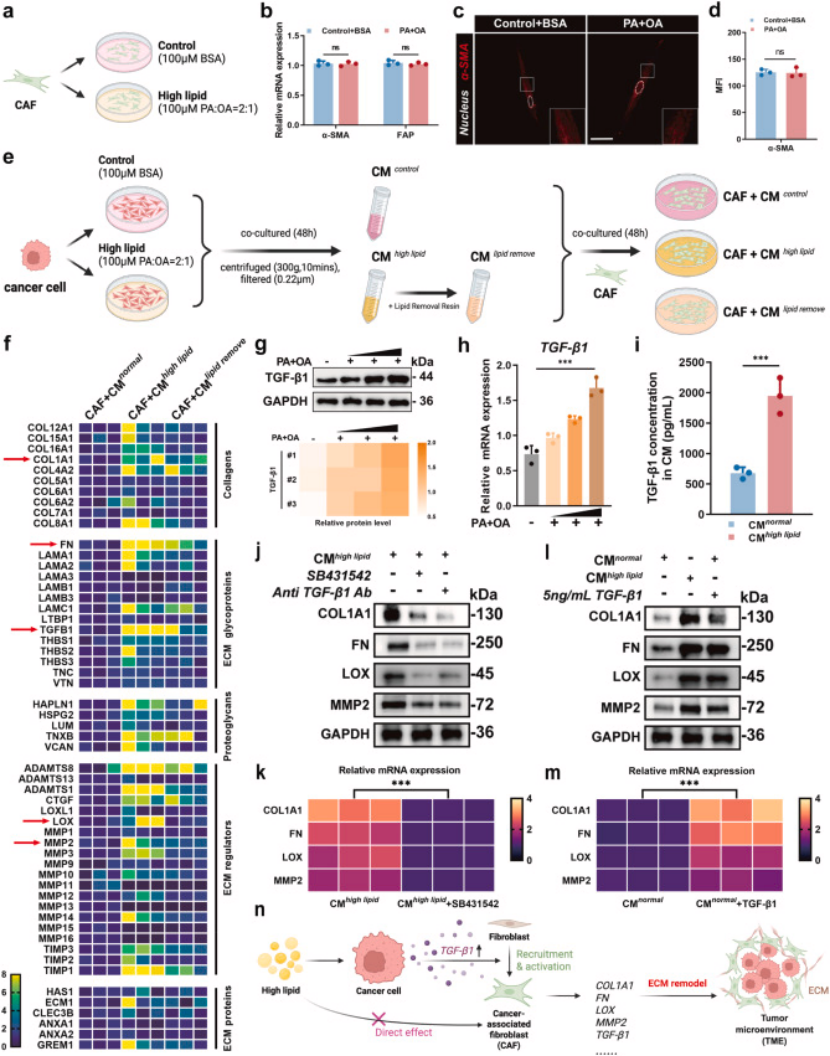
图3
3. 第三步:3D 生物凝胶模型,证实 Piezo1 是 ECM 僵硬介导耐药的关键传感器(图 4)
模型构建:制备软(20 kPa)、硬(100 kPa)两种 3D 生物凝胶,模拟不同僵硬程度的 ECM 微环境(图 4e);
核心验证:① 硬凝胶上的前列腺癌细胞 Piezo1 表达显著升高,对多西他赛的耐药性增强(凋亡率降低、IC50 升高,图 4g、i);② 敲低 Piezo1 或用 GsMTx4 抑制后,硬凝胶上的癌细胞耐药性显著逆转(图 4d、k、m);③ Piezo1 过表达则进一步增强耐药,且硬凝胶环境会放大这一效应(图 4j、l、n);
临床关联:高 Gleason 评分(GS9)肿瘤组织中 Piezo1 表达显著高于低评分(GS7),且 Piezo1 高表达患者总生存期更短(图 4a-c)。
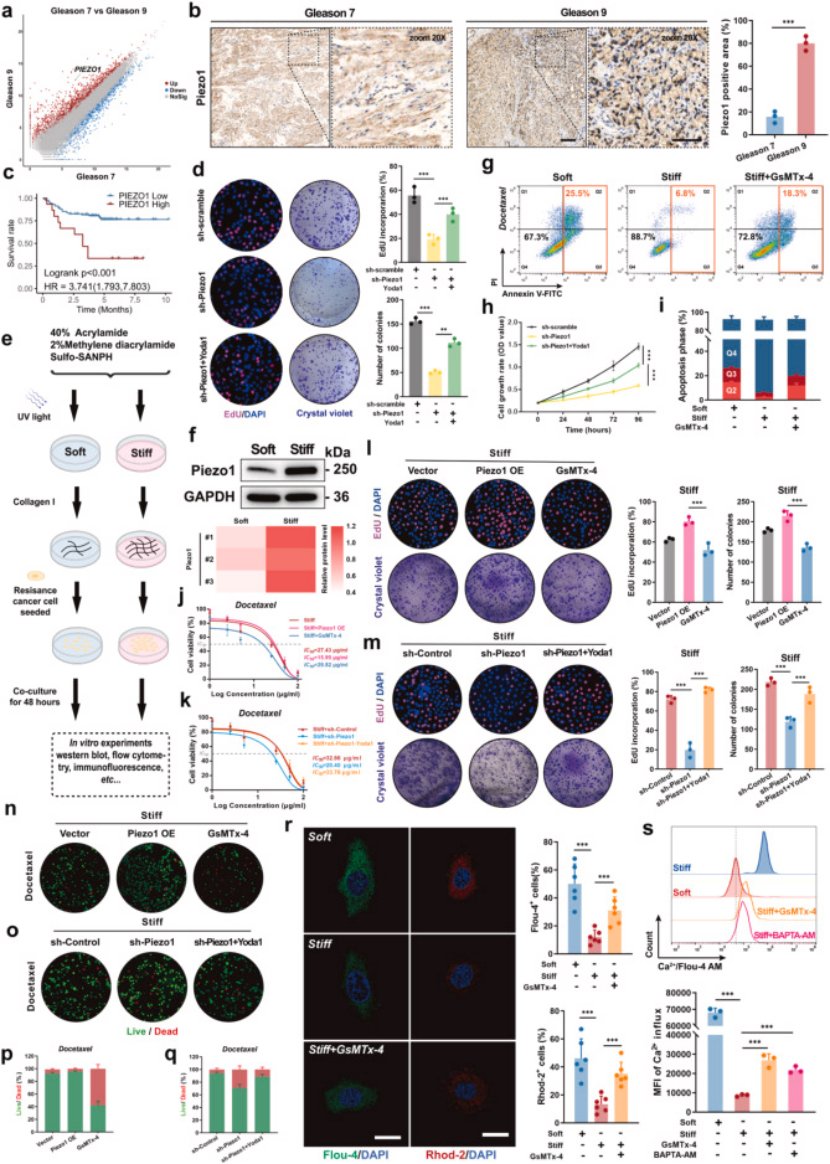
图4
4. 第四步:分子机制深挖,Piezo1 通过钙稳态 - MERCs 轴调控代谢重编程(图 5、6)
关键通路:ECM 僵硬激活 Piezo1,维持细胞钙稳态(抑制 Piezo1 则导致胞浆和线粒体钙超载,图 4r-s);
细胞器互作:Piezo1 激活促进线粒体 - ER 接触(MERCs)形成,免疫荧光共定位、透射电镜、邻近连接实验(PLA)均证实,硬凝胶上的癌细胞 MERCs 数量显著增加,GsMTx4 处理可破坏 MERCs(图 5a-j);
代谢重编程:MERCs 异常导致线粒体功能障碍(膜电位下降、ATP 生成减少、ROS 升高、线粒体碎片化,图 6a-g、i-j)和内质网应激(GRP78、CHOP 等标志物上调,图 6m-p),最终诱导化疗耐药;补充实验证实,过表达 MERCs 关键分子(VDAC1/GRP75)可恢复耐药表型。
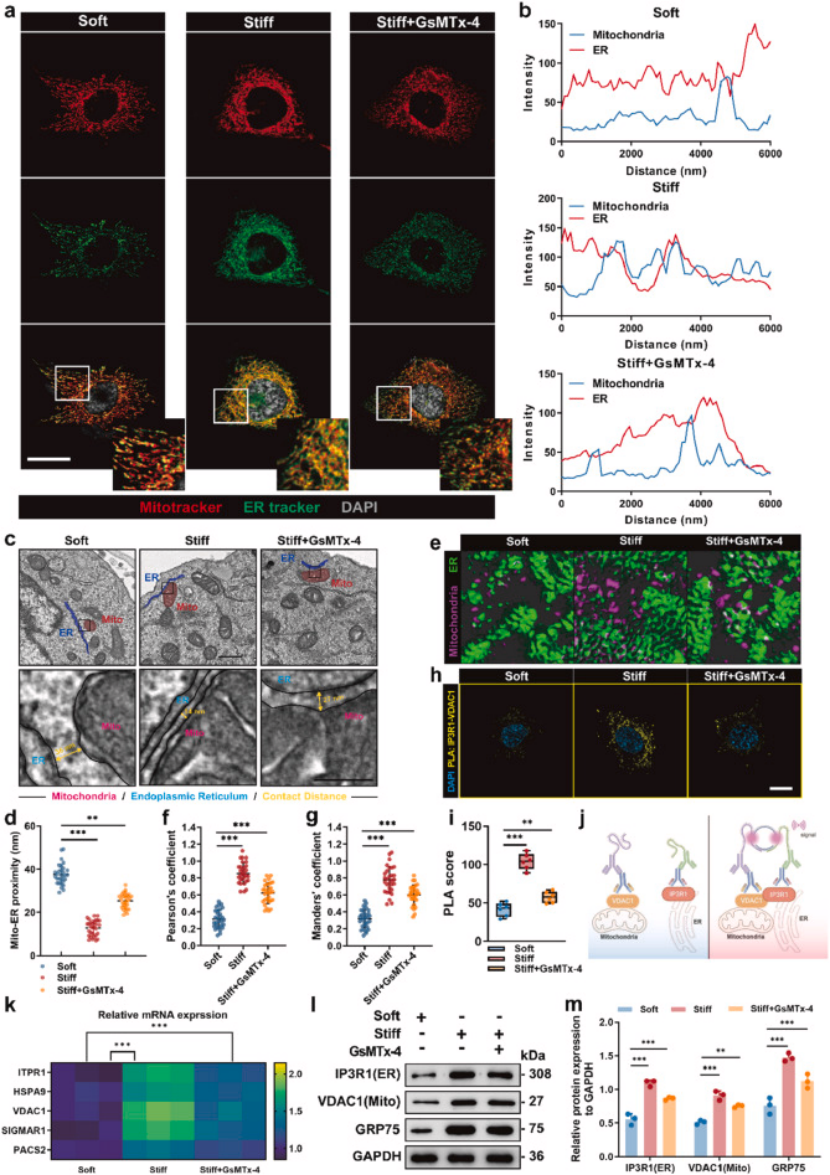
图5
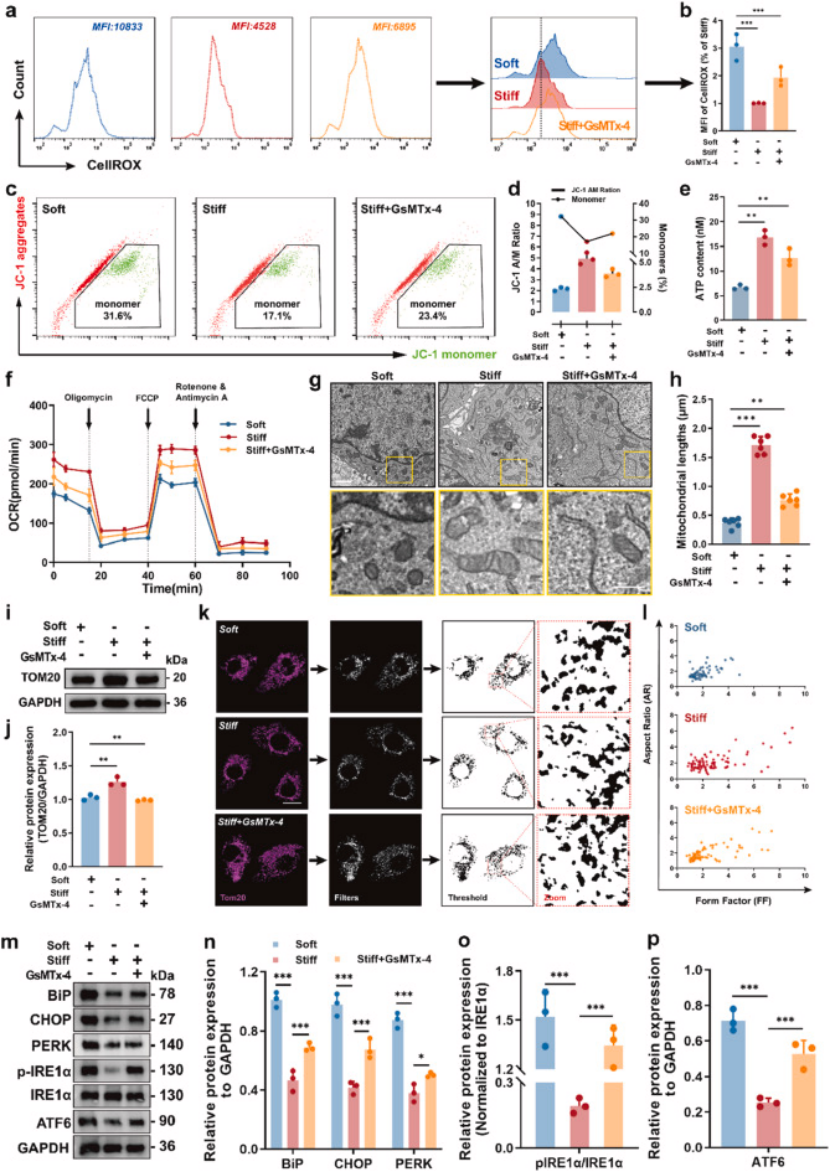
图6
5. 第五步:动物实验验证,双靶向治疗协同逆转化疗耐药(图 7、8)
干预方案:高脂饮食荷瘤小鼠分为对照组、多西他赛单药组、多西他赛 + 他汀组、多西他赛 + GsMTx4 组、多西他赛 + 他汀 + GsMTx4 组(图 7a);
核心结果:① 双靶向组(他汀 + GsMTx4 + 多西他赛)肿瘤体积和重量显著小于单药组,肿瘤抑制率最高(图 7b-d、g-i);② 病理检测显示,双靶向组癌细胞增殖(PCNA、Ki67)降低,凋亡(Caspase-3、TUNEL)增加(图 7e-f、j);③ ECM 重塑改善:天狼星红 / Masson 染色证实,双靶向组胶原沉积减少,ECM 僵硬程度显著降低(图 7k);
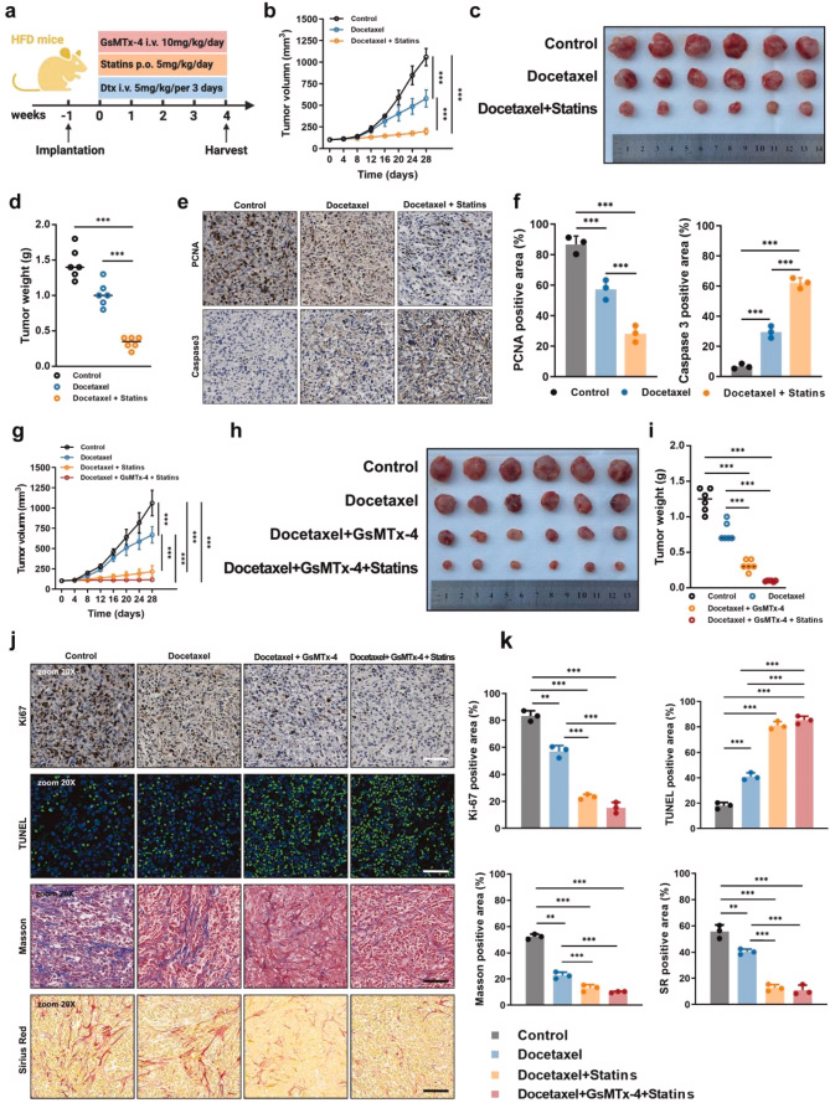
图7
机制示意图:图 8 清晰展示 “高脂饮食→TGF-β1→CAFs→ECM 僵硬→Piezo1→MERCs 异常→耐药” 及双靶向干预的作用靶点。
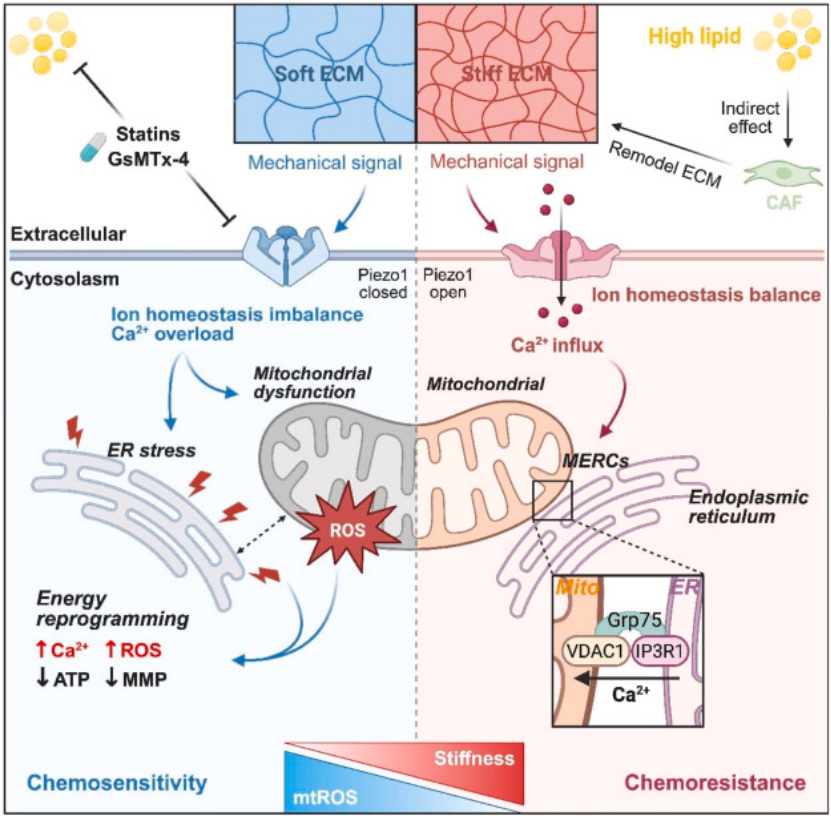
图8
总结:“代谢 - 机械” 双靶向,破解前列腺癌化疗耐药困局
中山大学附属第七医院联合团队通过临床队列、单细胞分析、3D 生物凝胶模型、动物实验及多组学技术,首次阐明高脂饮食诱导前列腺癌化疗耐药的核心机制:高脂饮食通过肿瘤细胞分泌 TGF-β1 间接激活 CAFs,引发 ECM 僵硬,进而通过机械传感器 Piezo1 调控钙稳态和 MERCs 形成,重塑能量代谢,最终诱导化疗耐药。
研究的最大突破在于提出“代谢 - 机械” 双靶向策略:他汀类药物调节脂质代谢、改善ECM 僵硬,Piezo1 抑制剂 GsMTx4 阻断机械信号、恢复 MERCs 稳态,两者协同多西他赛可显著逆转耐药,为晚期前列腺癌患者提供了全新的治疗方案。同时,研究建立了 “高脂饮食 - 血脂异常 - ECM 僵硬 - Piezo1 高表达” 的临床预警链条,为前列腺癌的风险分层和精准管理提供了重要依据。
DOI: 10.1016/j.canlet.2025.218204
专注期刊投稿、发表十年,任何投稿、写作难题欢迎咨询!


PAPER INFORMATION

快速预审、投刊前指导、专业学术评审,对文章进行评价

校对编辑、深度润色,让稿 件符合学术规范,格式体例等标准
.png)
适用于语句和结构尚需完善和调整的中文文章,确保稿件达到要求
.png)
数据库包括: 期刊、文书籍、会议、预印章、书、百科全书和摘要等

让作者在期刊选择时避免走弯路,缩短稿件被接收的周期

根据目标期刊格式要求对作者文章进行全面的格式修改和调整
.png)
帮助作者将稿件提交至目标期刊投稿系统,降低退稿或拒稿率
.png)
按照您提供的稿件内容,指导完成投稿附信(cover letter)

北京总部:北京市海淀区碧桐园 3 号楼 2 层 211 广州办事处:广州市黄埔区科学城国际企业孵化器 E栋306 联系人:客服 / 18163670350
Copyright © 2022-2024 北京特诺科技有限公司 版权所有 备案/许可证编号为: 京 ICP 备 2023007944 号